碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 时,氧化产物为_________;当 ,单质碘的收率会降低,原因是___________。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为__________。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。 在 溶液中可发生反应: 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如图:
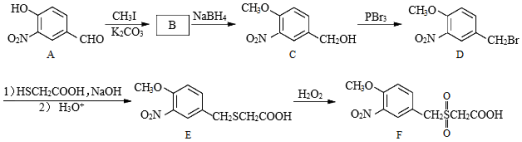
(1)A中的含氧官能团名称为硝基、 和 。
(2)B的结构简式为 。
(3)C→D的反应类型为 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α﹣氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
(5)写出以CH3CH2CHO和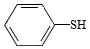 为原料制备
为原料制备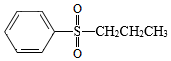 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
化合物F是合成吲哚﹣2﹣酮类药物的一种中间体,其合成路线如图:
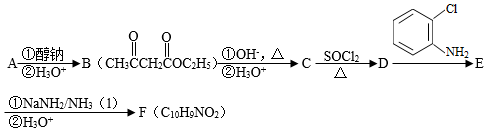
已知:Ⅰ.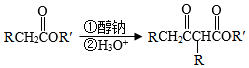
Ⅱ.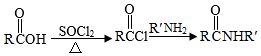
Ⅲ.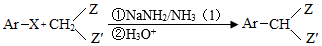
Ar为芳基;X=Cl,Br;Z或Z′=COR,CONHR,COOR等。
回答下列问题:
(1 )实验室制备A的化学方程式为 ,提高A产率的方法是 ; A的某同分异构体只有一种化学环境的碳原子,其结构简式为 。
(2)C→D的反应类型为 ; E中含氧官能团的名称为 。
(3)C的结构简式为 ,F的结构简式为 。
(4)Br2和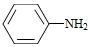 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以 和
和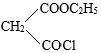 为原料合成
为原料合成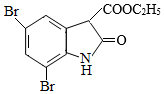 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
二氧化碳催化加氢合成乙烯是综合利用CO 2的热点研究领域。回答下列问题:
(1)CO 2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C 2H 4):n(H 2O)= 。当反应达到平衡时,若增大压强,则n(C 2H 4) (填"变大""变小"或"不变")。
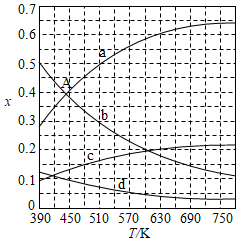
(2)理论计算表明。原料初始组成n(CO 2):n(H 2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。图中,表示C 2H 4、CO 2变化的曲线分别是 、 。 CO 2催化加氢合成C 2H 4反应的△H 0 (填"大于"或"小于")。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数K p= (MPa) ﹣ 3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C 3H 6、C 3H 8、C 4H 8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 ( 填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
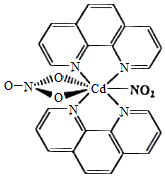
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 |
x |
y |
z |
Cd |
0 |
0 |
0 |
Sn |
0 |
0 |
0.5 |
As |
0.25 |
0.25 |
0.125 |
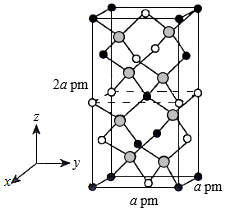
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn ( 用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。
[化学一一选修3: 物质结构与性质]
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1) 基态 Ge 原子的核外电子排布式为[Ar] ,有 个末成对电子。
(2) Ge 与 C 是同族元素, 原子之间可以形成双键、叁键, 但 原子之间难以形成双键或 叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点, 分析其变化规律及原因 。
|
|
|
|
熔点/ |
|
26 |
146 |
沸点/ |
|
186 |
约 400 |
(4) 光催化还原 制备 反应中,带状纳米 是该反应的良好催化剂。 、Ge、O 电负性由大至小的顺序是 。
(5) Ge 单晶具有金刚石型结构, 其中 原子的杂化方式为_ , 微粒之间存在的作用力是_ 。
(6)晶胞有两个基本要素:
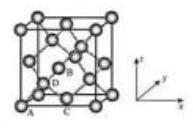
①原子坐标参数, 表示晶胞内部各原子的相对位置, 下图为 Ge 单晶的晶胞, 其中原子坐标参数 为 为 为 。则 原子的坐标参数为 。
②晶胞参数, 描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 , 其密度为 (列出计算式即可)。
【化学ーー选修2:化学与技术】
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 )为原料生产高锰酸钾的工艺路线如下:
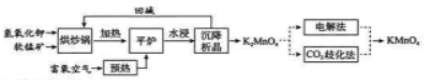
回答下列问题:
(1) 原料软锰矿与氢氧化钾按 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 转化为 的生产有两种工艺。
① 歧化法" 是传统工艺, 即在 溶液中通入 气体, 使体系呈中性或弱碱性,
发生歧化反应,反应中生成 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 歧化法" 中, 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 样品, 溶解后定容于 容量瓶中, 摇匀。取浓度为 的 标准溶液 , 加入稀硫酸酸化,用 溶液平行滴定三次, 平均消耗的体积为 , 该样品的纯度为 。
(列出计算式即可, 已知 ) 。
室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。一种基于 、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):
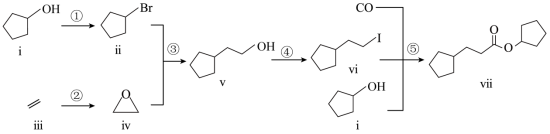
(1)化合物i的分子式为___________。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为___________(写一种),其名称为___________。
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为 。y为___________。
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
|
序号 |
反应试剂、条件 |
反应形成的新结构 |
反应类型 |
|
a |
___________ |
___________ |
消去反应 |
|
b |
___________ |
___________ |
氧化反应(生成有机产物) |
(4)关于反应⑤的说法中,不正确的有___________。
A. 反应过程中,有 键和 键断裂
B. 反应过程中,有 双键和 单键形成
C. 反应物i中,氧原子采取 杂化,并且存在手性碳原子
D. 属于极性分子,分子中存在由p轨道“头碰头”形成的 键
(5)以苯、乙烯和 为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
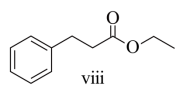
基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为___________(写结构简式)。
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为___________。
(c)从苯出发,第一步的化学方程式为___________(注明反应条件)。
丙烯腈(CH 2=CHCN)是一种重要的化工原料,工业上可用"丙烯氨氧化法"生产.主要副产物有丙烯醛(CH 2=CHCHO)和乙腈(CH 3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C 3H 3N)和副产物丙烯醛(C 3H 4O)。热化学方程式如下:①C 3H 6(g)+NH 3(g)+ O 2(g)═C 3H 3N(g)+3H 2O(g)△H=﹣515kJ•mol ﹣ 1
②C 3H 6(g)+O 2(g)═C 3H 4O(g)+H 2O(g)△H=﹣353kJ•mol ﹣ 1
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率________(填"是"或"不是")对应温度下的平衡转化率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号).

| A. |
催化剂活性降低 |
B. |
平衡常数变大 |
| C. |
副反应增多 |
D. |
反应活化能增大 |
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为________,理由是________.进料气氨、空气、丙烯的理论体积比约为________.
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
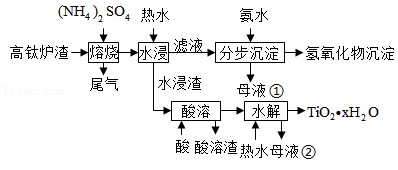
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 |
|
|
|
|
| 开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
| 沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。
次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为 ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
C3N3O3Cl2﹣+H++2H2O═C3H3N3O3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O I2+2S2O32﹣═S4O62﹣+2I﹣
准确称取1.1200g样品,用容量瓶配成250.0mL溶液:取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol•L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。
(写出计算过程,该样品的有效氯 100% )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ( 填“偏高”或“偏低”)。
近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注.大豆素的合成及其衍生化的一种工艺路线如下:
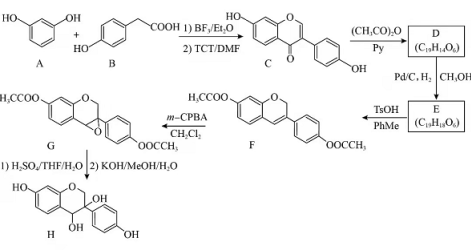
回答下列问题:
(1)A的化学名称为_______。
(2) 反应生成E至少需要______ 氢气。
(3)写出E中任意两种含氧官能团的名称_______。
(4)由E生成F的化学方程式为_________。
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为________。
(6)化合物B的同分异构体中能同时满足下列条件的有_______(填标号)。
a.含苯环的醛、酮
b.不含过氧键( )
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
| A. |
2个 |
B. |
3个 |
C. |
4个 |
D. |
5个 |
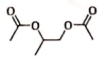
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成:
我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为"液态阳光"计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为______;单晶硅的晶体类型为_______。SiCl 4是生产高纯硅的前驱体,其中Si采取的杂化类型为______。SiCl 4可发生水解反应,机理如下:
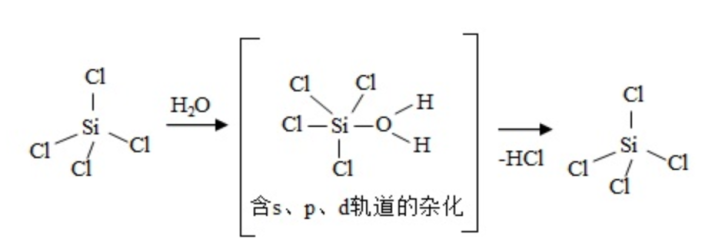
含s、p、d轨道的杂化类型有:①dsp 2、②sp 3d、③sp 3d 2,中间体SiCl 4(H 2O)中Si采取的杂化类型为_______ (填标号)。
(2)CO 2分子中存在________个σ键和________个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH 3SH,7.6℃)之间,其原因是_____________。
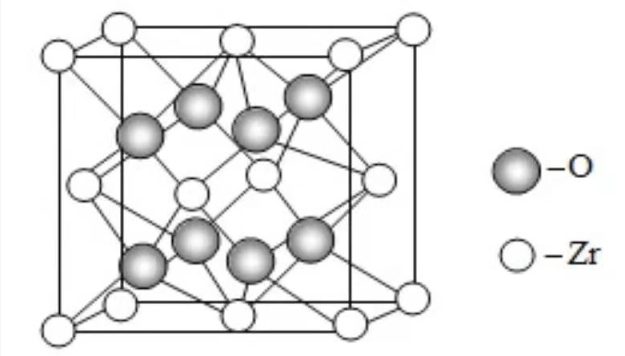
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO 2固溶体。四方ZrO 2晶胞如图所示。Zr 4+离子在晶胞中的配位数是____________,晶胞参数为 apm、 apm、 cpm,该晶体密度为____________g·cm -3(写出表达式)。在ZrO 2中掺杂少量ZrO后形成的催化剂,化学式可表示为Zn xZr 1- xO y,则 y=____________(用 x表达)。
[化学--选修5:有机化学基础]
化合物 是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1)A中的官能团名称是。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳 。
(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式:。(不考虑立体异构,只需写出3个)
(4)反应④所需的试剂和条件是。
(5)⑤的反应类型是。
(6)写出 到 的反应方程式: 。
(7)设计由甲苯和乙酰乙酸乙酯
制备 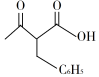 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
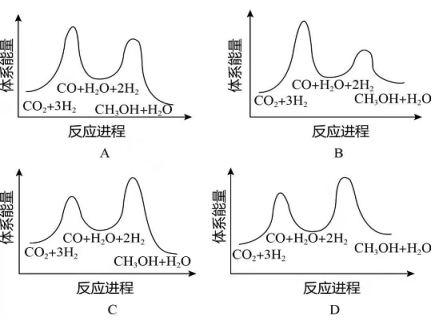
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
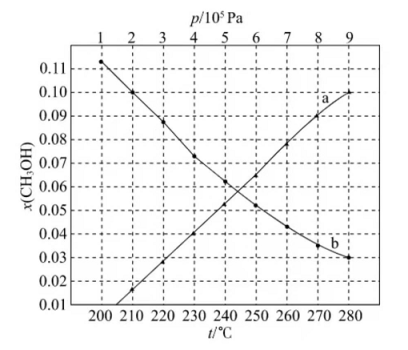
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。