[化学—选修5:有机化学基础]
白藜芦醇(化合物I)具有抗肿瘤、抗氧化、消炎等功效。以下是某课题组合成化合物I的路线。
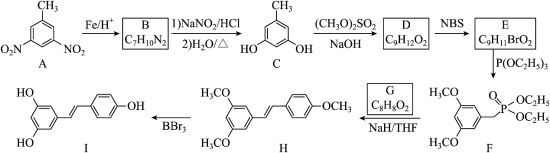
回答下列问题:
(1)A中的官能团名称为_____。
(2)B的结构简式为_____。
(3)由C生成D的反应类型为_____。
(4)由E生成F的化学方程式为_____。
(5)已知G可以发生银镜反应,G的化学名称为_____。
(6)选用一种鉴别H和I的试剂并描述实验现象_____。
(7)I的同分异构体中,同时满足下列条件的共有_____种(不考虑立体异构)。
①含有手性碳(连有4个不同的原子或基团的碳为手性碳);
②含有两个苯环;
③含有两个酚羟基;
④可发生银镜反应。
氰基丙烯酸酯在碱性条件下能快速聚合为 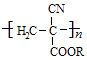 从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
② 
回答下列问题:
(1)A的化学名称为________.
(2)B的结构简式为________.其核磁共振氢谱显示为________组峰,峰面积比为________.
(3)由C生成D的反应类型为________.
(4)由D生成E的化学方程式为________.
(5)G中的官能团有________、________、________.(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有________种.(不含立体结构)
某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________.
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为________.
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________.
(4)丙组同学取10mL 0.1mol•L﹣1KI溶液,加入6mL 0.1mol•L﹣1 FeCl3溶液混合.分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红.
实验②检验的离子是________(填离子符号);实验①和③说明:在I﹣过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________.
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是________,生成沉淀的原因是________(用平衡移动原理解释).
[化学--选修5:有机化学基础]
化合物 是一种药物合成中间体,其合成路线如下:
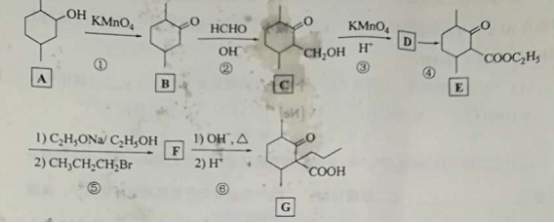
回答下列问题:
(1)A中的官能团名称是。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳 。
(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式:。(不考虑立体异构,只需写出3个)
(4)反应④所需的试剂和条件是。
(5)⑤的反应类型是。
(6)写出 到 的反应方程式: 。
(7)设计由甲苯和乙酰乙酸乙酯
制备 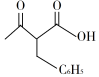 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
[化学-一选修 5: 有机化学基础]
秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化 合物的路线:
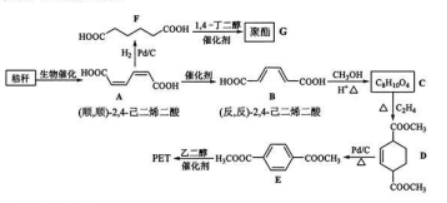
回答下列问题:
(1)下列关于糖类的说法正确的是_ (填标号)
A. 糖类都有甜味, 具有 的通式
B. 麦芽糖水解生成互为同分异构体的葡萄糖和果糖
C. 用银镜反应不能判断淀粉水解是否完全
D. 淀粉和纤维素都属于多糖类天然高分子化合物
(2) 生成 的反应类型为 。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4) 的化学名称是 , 由 生成 的化学方程式为 .
(5)具有一种官能团的二取代芳香化合物 是 的同分异构体, 与足量碳酸氢钠溶液反应生成 共有 种(不含立体结构 , 其中核磁共振氢谱为三组峰的结构简式为 .
(6) 参照上述合成路线,以(反,反)-2, 4-己二烯和 为原料(无机试剂任选 ), 设计制备对二苯二甲酸的合成路线_ 。
近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注.大豆素的合成及其衍生化的一种工艺路线如下:
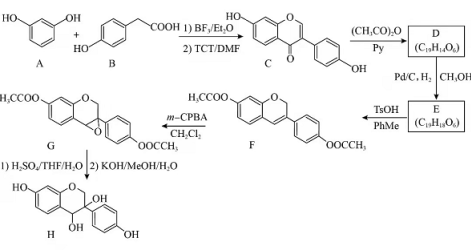
回答下列问题:
(1)A的化学名称为_______。
(2) 反应生成E至少需要______ 氢气。
(3)写出E中任意两种含氧官能团的名称_______。
(4)由E生成F的化学方程式为_________。
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为________。
(6)化合物B的同分异构体中能同时满足下列条件的有_______(填标号)。
a.含苯环的醛、酮
b.不含过氧键( )
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
| A. |
2个 |
B. |
3个 |
C. |
4个 |
D. |
5个 |
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成:
我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为"液态阳光"计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为______;单晶硅的晶体类型为_______。SiCl 4是生产高纯硅的前驱体,其中Si采取的杂化类型为______。SiCl 4可发生水解反应,机理如下:
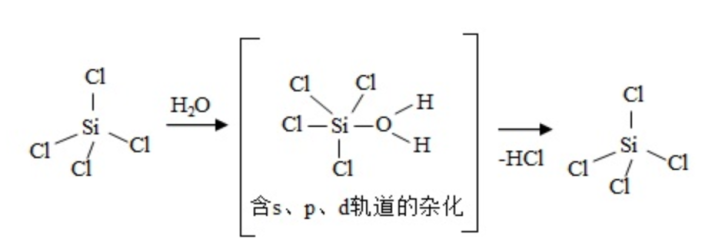
含s、p、d轨道的杂化类型有:①dsp 2、②sp 3d、③sp 3d 2,中间体SiCl 4(H 2O)中Si采取的杂化类型为_______ (填标号)。
(2)CO 2分子中存在________个σ键和________个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH 3SH,7.6℃)之间,其原因是_____________。
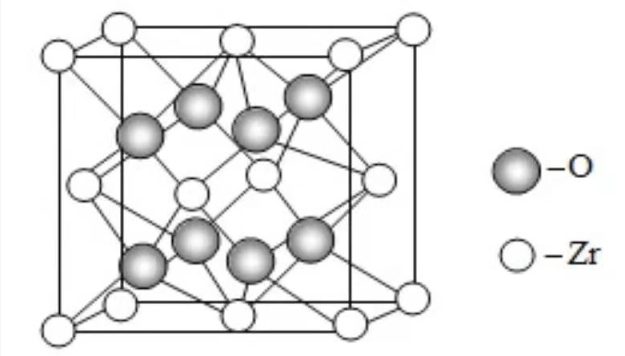
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO 2固溶体。四方ZrO 2晶胞如图所示。Zr 4+离子在晶胞中的配位数是____________,晶胞参数为 apm、 apm、 cpm,该晶体密度为____________g·cm -3(写出表达式)。在ZrO 2中掺杂少量ZrO后形成的催化剂,化学式可表示为Zn xZr 1- xO y,则 y=____________(用 x表达)。
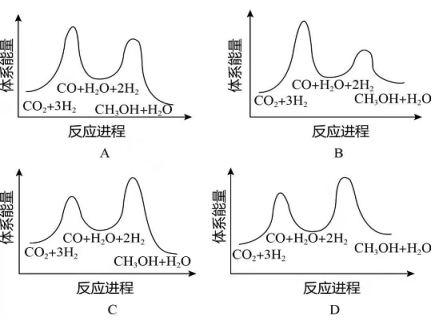
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
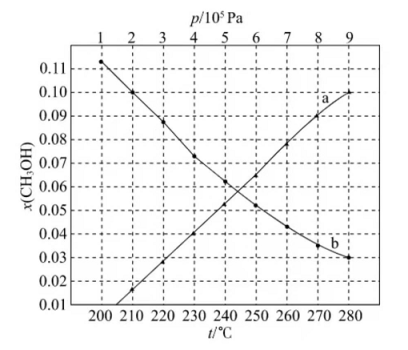
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
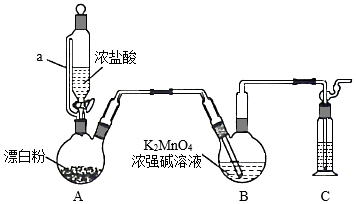
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42﹣+2H2O═2MnO4﹣+MnO2↓+4OH﹣
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 酸式 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用c mol•L﹣1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4•2H2O(M=126g•mol﹣1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. 3时,样品中一定不含杂质
B. 越大,样品中H2C2O4•2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
苯基环丁烯酮( 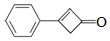 PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如图:
PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如图:
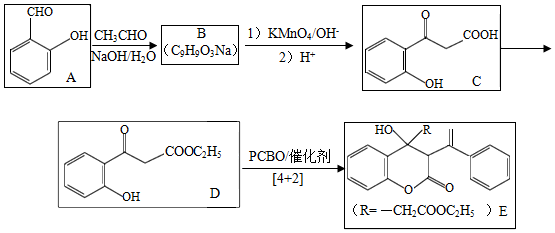
已知如下信息:
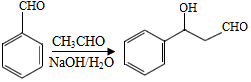
回答下列问题:
(1)A的化学名称是 。
(2)B的结构简式为 。
(3)由C生成D所用的试剂和反应条件为 ;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C 8H 8O 2的副产物,该副产物的结构简式为 。
(4)写出化合物E中含氧官能团的名称 ;E中手性碳(注:连有四个不同的原子或基团的碳)的个数为 。
(5)M为C的一种同分异构体。已知:1mol M与饱和碳酸氢钠溶液充分反应能放出2mol二氧化碳;M与酸性高锰酸钾溶液反应生成对苯二甲酸。M的结构简式为 。
(6)对于 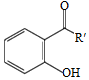 ,选用不同的取代基R',在催化剂作用下与PCBO发生的[4+2]反应进行深入研究,R'对产率的影响见下表:
,选用不同的取代基R',在催化剂作用下与PCBO发生的[4+2]反应进行深入研究,R'对产率的影响见下表:
|
R' |
﹣CH 3 |
﹣C 2H 5 |
﹣CH 2CH 2C 6H 5 |
|
产率/% |
91 |
80 |
63 |
请找出规律,并解释原因 。