将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得5.6g不溶物和滤液;然后在滤液中加入足量的NaOH溶液,过滤后将沉淀灼烧,得16g红棕色固体。
(1)红棕色固体的化学式是 ,其中的n(Fe)= mol。
(2)请计算(写出计算过程):
①该矿石中铁氧化物的化学式。
②若加入的稀盐酸为4.0mol·L -1200mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是多少?
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。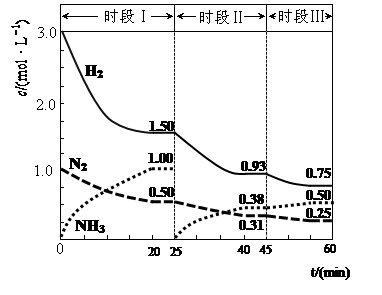
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。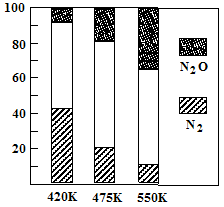
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,请回答
(1)NO2的体积为 。
(2)待产生的气体全部释放后,向溶液中加入VmL n mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为 mol·L-1.
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
将等物质的量的N2、H2混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中C(N2):C(H2) = 3︰1;若将混合气体中氨气分离,恰好能与250mL 2mol/L的稀硫酸溶液反应生成正盐;
求:(1)NH3的化学反应速率是多少?
(2)原容器中N2的物质的量是多少?
(3)5min后容器中H2的物质的量浓度是多少?
(4)N2的转化率是多少?
(要求书写计算过程)
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
| |
SrSO4 |
BaSO4 |
Sr(OH)2 |
| Ksp |
3.3×10—7 |
1.1×10—10 |
3.2×10—4 |
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
已知:CO(g) + H2O(g) CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) △H = 。
CH3CH2OH(g) +3H2O(g) △H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。
②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g) N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol∙L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
1.00 |
0 |
0 |
| 20 |
0.40 |
0.30 |
0.30 |
| 30 |
0.40 |
0.30 |
0.30 |
| 40 |
0.32 |
0.34 |
0.17 |
| 50 |
0.32 |
0.34 |
0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol ①
C(s)+ CO2(g)  2CO(g) ΔH2="+172.5" kJ/mol ②
2CO(g) ΔH2="+172.5" kJ/mol ②
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) ΔH3="-13.7" kJ/mol ③
请回答下列问题:
(1) 计算3 Fe(s)+2 O2(g)= Fe3O4(s)的ΔH=__________________________。
(2) 800℃时,C(s)+ CO2(g)  2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
(3) 某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
计算:①该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式( m、n为正整数)。
除去杂质后的水煤气主要含H2、CO,是理想的合成甲醇的原料气。
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g) 2CO(g) △H1;
2CO(g) △H1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g) CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;
上述反应△H3与△H1、△H2之间的关系为 。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:2CH4(g)+3O2(g) 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)请在答题卡中,画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.20 |
0.10 |
0.40 |
①该时间段内平均反应速率v(H2)= 。
②比较此时正、逆反应速率的大小:v(正) v (逆)(填“>”、“<”或“=”)
(5)生产过程中,合成气要进行循环,其目的是 。
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3。时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:____________________________。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为_______________。充分反应后温度降至____________以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的____(填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式 ________;与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al):m(Pb)=_________________。
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________。
(3)若将ZnS溶于强酸可产生硫化氢气体。在120 oC、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数。(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
(6分)由一种气态烷烃和一种气态单烯烃组成的混合气体,它对H2的相对密度是13.2,将1L的混合气体和4LO2在容积固定的密闭容器中完全燃烧并保持原来的温度(120℃),测得密闭容器内压强比反应前增加了4%,试确定混合气体的成分及体积比。
某饱和有机物A由碳、氢、氧三种元素组成,现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢元素和碳元素的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
(3)若核磁共振氢谱中出现三个信号峰,且强度之比为3:3:2,请写出该有机物的结构简式。
(5分)向100 mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
(1)加入B溶液110 mL时,溶液中的沉淀是 ,溶液中的溶质是 。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:
Ba2+ + SO42—→BaSO4↓,Al(OH)3 + OH— →AlO2— +2H2O
溶液B中Na2SO4与NaOH的物质的量浓度之比为 ;
(3)计算A溶液中AlCl3的物质的量浓度,写出计算过程: