[广东]2013届广东省潮州市高三第二次高考模拟考试理综化学试卷
2012年入冬以来,雾霾天气已经严重影响了我国多数人的正常出行和生活节奏。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
| A.加高工厂的烟囱,使烟尘和废气远离地表 |
| B.启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
| C.研制新型高效可充电电池,发展纯电动汽车 |
| D.尽快将我国汽油生产标准由“国III”提高到“国IV”甚至“国V” |
下列说法正确的是
| A.乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 |
| B.棉、丝、羽毛、塑料及合成橡胶完全燃烧都只生成CO2和H2O |
| C.纤维素、合成纤维、光导纤维都是有机高分子化合物 |
| D.液化石油气可由石油分馏获得,汽油可由石油分馏或石油裂化获得 |
以NA表示阿伏加德罗常数,下列说法中正确的是
| A.在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 |
| B.0.1mol·L-1氯化钡溶液中Cl-数是0.2NA |
| C.18gD2O所含电子数目为10NA(相对原子质量:O-16) |
| D.4g氦气所含分子数为NA(相对原子质量:He-4) |
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
下列各组离子能大量共存的是
| A.NaClO水溶液中:Fe2+、Cl-、Ca2+、H+ |
| B.加入KSCN显红色的溶液:K+、Na+、I-、S2- |
| C.无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4- |
| D.pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是
A.D元素的金属性在短周期元素中最强
B.E单质常用作半导体材料和光导纤维
C.A和B只能形成原子个数比1︰2的化合物
D.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
用下列实验装置进行相应的实验,能达到实验目的的是
| A.图I用于实验室制氨气并收集干燥的氨气 | B.图II用于除去CO2中含有的少量HCl |
| C.图III用于提取I2的CCl4溶液中的I2 | D.图IV用于检查碱式滴定管是否漏液 |
下一代iPhone将在电池方面有所改进,该电池的一极为一种有机高分子游离基(用R表示)和石墨粉及粘结剂的复合材料,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中。该游离基(R)在空气中十分稳定,在充电时被氧化成阳离子(Rx+),电池充放电的方程式为:xLi+Rx+ xLi++R。下列有关说法正确的是
xLi++R。下列有关说法正确的是
| A.放电时,该电池将电能转化为化学能 | B.充电时,Rx+由阴极向阳极移动 |
| C.放电时,负极反应为xLi-xe-==xLi+ | D.充电时,阳极反应为R-xe-==Rx+ |
增塑剂(又叫塑化剂)是一种增加塑料柔韧性、弹性等的添加剂,不能用于食品、酒类等行业。DBP(邻苯二甲酸二丁酯)是增塑剂的一种,可由下列路线合成:
已知以下信息:
①
②
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D→E的反应类型 。
(2)DBP的分子式为 ,D的结构简式是 。
(3)由B和E以物质的量比1︰2合成DBP的化学方程式:
。
(4)写出同时符合下列条件的B的所有同分异构体结构简式 。
①能和NaHCO3溶液反应生成CO2 ③能使FeC13溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
除去杂质后的水煤气主要含H2、CO,是理想的合成甲醇的原料气。
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g) 2CO(g) △H1;
2CO(g) △H1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g) CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;
上述反应△H3与△H1、△H2之间的关系为 。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:2CH4(g)+3O2(g) 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)请在答题卡中,画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.20 |
0.10 |
0.40 |
①该时间段内平均反应速率v(H2)= 。
②比较此时正、逆反应速率的大小:v(正) v (逆)(填“>”、“<”或“=”)
(5)生产过程中,合成气要进行循环,其目的是 。
某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下: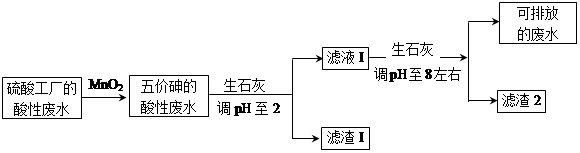
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 |
Ksp |
| Ca3(AsO4)2 |
6.8×10-19 |
| CaSO4 |
9.1×10-6 |
| FeAsO4 |
5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 |
H2SO4 |
As |
| 废水浓度 |
29.4g/L |
1.6g·L-1 |
| 排放标准 |
pH 6~9 |
0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于乙醇,熔点5.5℃,沸点267℃。1-萘酚(性质与苯酚相似)熔点96℃,沸点278℃,微溶于水,易溶于乙醇,乙醇的沸点为78.5℃。1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下: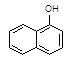 +C2H5OH
+C2H5OH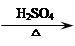
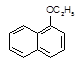 +H2O
+H2O
1-萘酚 1-乙氧基萘
(1)将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 。烧瓶上连接长直玻璃管的主要作用是 。 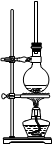
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是 (填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是 、 。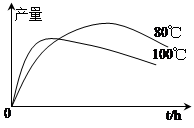
(4)某同学推测经提纯的产品可能还含有1-萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请在答题卡上完成表中内容。
| 实验目的 |
实验操作 |
预期现象和结论 |
| ①用金属钠检验1-乙氧基萘是否纯净 |
取少量经提纯的产品于试管A中,加入金属钠 |
若 ,则产品纯净; 若 ,则产品不纯。 |
| ②检验经提纯的产品是否含有1-萘酚 |
|
若 ,则含有1-萘酚; 若 ,则不含1-萘酚。 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号