常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
(1)原混合溶液中NaCl和CuSO4的物质的量浓度。
(2)电解至t3时,消耗水的质量。
(12分)达喜[AlaMgb(OH)c(CO3)d·xH2O]常用于中和胃酸。
(1)1 mol达喜与足量的盐酸完全反应后生成水的物质的量为________(用含x等字母的代数式表示)。
(2)达喜化学式中a、b、c、d的关系为a+b________c+d(填“>”、“=”或“<”)。
(3)已知在常温下溶液中Al3+、Mg2+、AlO2-的浓度与溶液pH的关系如图所示。为测定达喜的组成,进行了下列实验: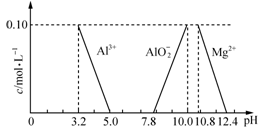
①取达喜6.02 g研碎,缓慢加入2.00 mol·L-1盐酸使其溶解,当加入盐酸85.00 mL时开始产生CO2,加入盐酸至90.00 mL时正好反应完全。
②在①所得溶液中加入适量的________(填“氨水”、“氢氧化铝”或“氯化镁”)以调节溶液的pH至5.0~7.0,使有关离子完全沉淀。
③将②产生的全部沉淀过滤、洗涤,灼烧至恒重,称量为1.02 g。
请通过计算确定达喜的化学式(写出计算过程)。
锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下: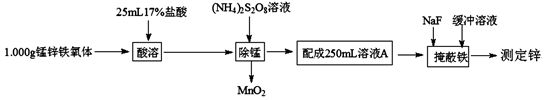
(1)a、b、c的代数关系式为。
(2)“除锰”时发生反应的离子方程式为。
(3)配制溶液A用的玻璃仪器有、烧杯、玻璃棒及胶头滴管。
(4)准确量取25.00 mL溶液A,二甲酚橙作指示剂,用0.01000mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应原理为Zn2++H2Y2-=ZnY2-+2H+),至滴定终点时消耗EDTA 标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数(写出计算过程)。
(12分)铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.750 0 g试样中加入100.00 mL 0.120 0 mol·L-1 KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.100 0 mol·L-1FeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1 g KI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-===2CuI↓+I2。用0.050 00 mol·L-1 Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗14.00 mL。
),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
将等物质的量的N2、H2混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中C(N2):C(H2) = 3︰1;若将混合气体中氨气分离,恰好能与250mL 2mol/L的稀硫酸溶液反应生成正盐;
求:(1)NH3的化学反应速率是多少?
(2)原容器中N2的物质的量是多少?
(3)5min后容器中H2的物质的量浓度是多少?
(4)N2的转化率是多少?
(要求书写计算过程)
一定条件下,将a mol N2与17 mol H2的混合气体通入一固定体积为V L的密闭容器中,发生如下反应:
(1)若反应进行到t min时,n(N2)="2" mol ,n(NH3)="6" mol ,计算a的值;此时N2的转化率是多少?
(2)在t min时,H2的体积百分数是多少?(要求简写解题过程)
将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,请回答
(1)NO2的体积为 。
(2)待产生的气体全部释放后,向溶液中加入VmL n mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为mol·L-1.
(本题共14分)硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O ----①
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3 ----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数
是(保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?(写出计算过程)
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。
完成下列计算:
50.将7.8克Na2O2完全溶解于93.8克水中,所得溶液的质量百分比浓度为。
51.将11.6克二氧化碳和水蒸汽的混合物与足量的Na2O2充分反应,固体质量增加了3.6克,则原混合气体的平均分子量为。
52.向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水)。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示。
(1)推断b点时M的组成成份(写出计算过程)。
(2)若向b点的盐溶液中只加入0.03mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO3 8.48g,则加入的物质可以是________或_______。
53.由31g NaOH和NaHCO3的固体混合物,在密闭密器中加热到250℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成份(已知NaHCO3的分解温度低于250℃).
氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
1.
质量分数为0.90的石灰石100
完成分解产生
(标准状况)。石灰窑中,该29120
(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生
,则焦炭的物质的量为mol。
2.已知粗盐水含
6.80
,含
3.00
。
向粗盐水中加入
除镁离子:
然后加入
除钙离子。
处理上述粗盐水10
,至少需要加
g。
如果用碳酸化尾气(含
体积分数为0.100、
体积分数0.040)代替碳酸钠,发生如下反应:
处理上述10
粗盐水至少需要通入多少
(标准状况)碳酸化尾气?列式计算。
3.某氨盐水含氯化钠1521 ,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 。列式计算:
(1)过滤后溶液中氯化钠的质量。
(2)析出的碳酸氢钠晶体的质量。
(5分)向100 mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
(1)加入B溶液110 mL时,溶液中的沉淀是,溶液中的溶质是。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:
Ba2+ + SO42—→BaSO4↓,Al(OH)3 + OH— →AlO2— +2H2O
溶液B中Na2SO4与NaOH的物质的量浓度之比为;
(3)计算A溶液中AlCl3的物质的量浓度,写出计算过程:
计算题
(1)某元素的同位素X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,求:元素X的Z值和A值?
(2)在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol/L和0.1 mol/L。向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是多少?
已知:Fe2+能被稀硝酸氧化,反应方程式:3Fe(NO3)2+ 4HNO3(稀) ="=" 3 Fe(NO3)3+ NO↑+ 2H2O
现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
| 硝酸体积(mL) |
100 |
200 |
300 |
400 |
| 剩余固体(g) |
18.0 |
9.6 |
0 |
0 |
| 放出气体的体积(mL) |
2240 |
4480 |
6720 |
(1)放出4480 mL气体时,消耗金属的质量为_______g
(2)稀硝酸的浓度为_______mol·L-1
(3)计算原混合物中铁和铜的物质的量比为
(4)加入400 mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为。
(本题共14分)工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为(保留两位小数)。
某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为m3(保留两位小数)。
一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数。
合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H2 2CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。