实验室常用MnO2与浓盐酸加热制备Cl2,反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,某小组同学提出的下列实验方案:向足量的二氧化锰中加入12.0mL的浓盐酸,加热,反应结束时收集到336mLCl2(标准状况);将反应后得到的残余液过滤、洗涤滤渣,洗涤液和滤液混合;向滤液中加入足量的AgNO3溶液,过滤、洗涤、干燥后得到固体11.48g。计算
(1)参加反应的二氧化锰的质量。
(2)将生成的Cl2通到NaOH溶液中制得100mL消毒液,求消毒液中有效成分的物质的量浓度。
(3)浓盐酸能和二氧化锰反应的生成Cl2的最低浓度(假设反应后残余液体积为12mL)。(保留至0.01)
将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得5.6g不溶物和滤液;然后在滤液中加入足量的NaOH溶液,过滤后将沉淀灼烧,得16g红棕色固体。
(1)红棕色固体的化学式是 ,其中的n(Fe)= mol。
(2)请计算(写出计算过程):
①该矿石中铁氧化物的化学式。
②若加入的稀盐酸为4.0mol·L -1200mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是多少?
现有铜、银合金14g与足量的某浓度的硝酸100mL发生反应,将生成的气体与1.12L(标况)氧气混合,通入足量的水中恰好全部吸收,反应后溶液体积仍为100mL。试通过计算回答下列问题:
(1)原固体混合物中铜和银的质量各是多少?
(2)若原硝酸溶液为浓硝酸,反应产生的气体是单一气体,则该反应中被还原的硝酸的物质的量是多少?
(3)合金完全溶解后,若生成的气体在标况下体积为2.24L,反应后溶液中c(H+)=7mol/L,则该混合气体中NO和NO2在标准状况下的体积分别是多少?原硝酸的浓度是多少?
硝酸在化学工业中有着极其广泛的应用。
(1)将1.25 mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。
(2)向稀硝酸中加入18.4 mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8 g/cm3)以下时,则失去吸水能力。50 mL 18.4 mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比 =______________。
=______________。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35molNaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x = 。
把20.95g干燥的氯酸钾与二氧化锰的混合物装入大试管中,加热到质量不变为止,剩余固体为16.15g,则:
(1)求生成的气体在标态下的体积
(2)剩余固体各成分的物质的量
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体,通入过量的碘化钾溶液,生成的碘被0.02mol Na2S2O3吸收,则生成的两种气体的体积(标态)是多少升?(已知:2Na2S2O3 +I2 → Na2S4O6+2NaI)
H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是 ;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分及物质的量之比是 ;
回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子方程式: 。
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
硝酸与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径。
完成下列计算:
52.合成氨时,假设100L的氮气与氢气(体积比为1 : 3)的混合气体通过氨合成塔充分反应后,体积变为90L,则氮气的转化率为 。(写出计算过程,计算结果请用百分数表示)
53.标准状况下,将500L氨气溶于1L水中形成氨水,则此氨水质量分数为 。(写出计算过程,计算结果请用百分数表示,并保留1位小数)
54.氨氧化法是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。此时温度很高,水以水蒸气的形式存在,NO也不与O2反应。若氨气与氧气物质的量之比为1:1.7时,氨的转化率可达95%,计算反应后NO的体积分数 。(设氧气在空气中的体积分数为20%,写出计算过程,计算结果请用百分数表示并保留1位小数)
55.一氧化氮继续氧化为二氧化氮,二氧化氮溶于水可得硝酸。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。( 已知金不溶于浓硝酸)
填写该18K金的成分表(写出计算过程,计算结果请用百分数表示并保留1位小数,若不含该金属则填0)。
| 18K金成分 |
Au |
Ag |
Cu |
| 含量(质量分数) |
75 % |
_________ |
_________ |
用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
| 离子 |
离子浓度(mol·L-1) |
|
| 还原前 |
还原后 |
|
| SO42- |
3.20 |
3.50 |
| Fe2+ |
0.15 |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO 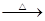 CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1)原混合气体的物质的量是 ;生成沉淀的摩尔质量是 。
(2)原混合气体中甲烷的体积是 。
取一定量Na2CO3和Na2SO4的混合溶液与90ml盐酸恰好反应,生成2.016 L CO2(标准状况下),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少? 盐酸的物质的量的浓度为多少?
中国青铜器制作精美,享有极高的艺术价值。古代曾采用湿法炼铜,用铁与硫酸铜溶液反应置换出铜。现有足量的铁片,将其投入到80.0g硫酸铜溶液中,充分反应后,取出铁片,经称量,溶液的质量变为79.2g。试计算:
(1)参加反应的铁片的质量。
(2)原硫酸铜溶液中溶质的质量分数。
计算(将所得结果填在相应的空格内,共14分)
(1)在3L的密闭容器中充入2 mol A气体和2 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,则A的转化率为 。
2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,则A的转化率为 。
(2)某金属与足量稀硝酸充分反应,无气体放出,再向该溶液中加入过量NaOH溶液,加热,收集到标况下气体0.224升,整个过程转移电子的物质的量为 mol。
(3)在100 mL 混合溶液中,HNO3 和 H2SO4 的物质的量浓度分别是0.1 mol/L,0.4 mol/L向该混合液中加入 2.56g铜粉,加热待充分反应后,所得溶液中 Cu2+ 的物质的量浓度是 mol/L (假设溶液体积不变)。
(4)在1L2mol/L的AlCl3溶液中,加入1mol/L的NaOH溶液,产生了39g沉淀,则加入NaOH溶液的体积为 。
(5)钠、镁、铝均为0.2mol分别与 mL浓度为1mol/L的HCl溶液反应,产生氢气量相等。
(6)将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,气体全部逸出后,向溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为 mol/L。(结果须化简)
(7)已知1 g氢气完全燃烧生成水蒸气时放出热量a kJ,且氧气中1 mol O=O键完全断裂时吸收热量bkJ,水蒸气中1 mol H-O键形成时放出热量c kJ,则氢气中1 mol H-H键断裂时吸收热量为 kJ。
将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式。