某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
| 次 数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀盐酸质量 /g |
25 |
25 |
25 |
25 |
| 反应后烧杯中物质的总质量 /g |
m |
58.4 |
82.6 |
107.6 |
求:(1)生成二氧化碳的总质量是 g。
(2)第1次加入稀盐酸充分反应后,烧杯中物质的总质量是 g。
(3)该石灰石样品中碳酸钙的质量分数。(写出计算过程)
为定量研究长期放置氢氧化钠药品变质情况,化学兴趣小组的同学设计了如下实验,其主要实验步骤如下:
Ⅰ.按图组装仪器,将55.0g试样放入锥形瓶中,加入足量稀硫酸溶液;
Ⅱ.测量一定时间内装置丁内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量装置丁内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至装置丁内物质质量不变.
请根据实验数据,通过计算分析氢氧化钠变质情况(“全变质”,“部分变质”或“不变质”,要有详细的计算步骤,没有步骤不得分)
氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2 L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(2)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。
向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
然后加入Na2CO3除钙离子。
处理上述粗盐水10 m3,至少需要加Na2CO3 g。
如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
(3)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:
①过滤后溶液中氯化钠的质量。
②析出的碳酸氢钠晶体的质量。
向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示
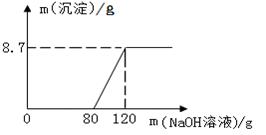
(1)计算氢氧化钠溶液的溶质质量分数;(要求写出计算过程)
(2)与氢氧化钠溶液反应所消耗硫酸溶质的质量为 克。
鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题(可以选下列任意两个问题回答,并写出计算过程):
(1)反应①产生的CO2的质量为___________________;
(2)该鸡蛋壳中碳酸钙的质量分数为________________;
(3)所加氢氧化钙的质量为__________________;
(4)溶液b中溶质的质量分数为_________________;
计算过程:
某地规定工业排放的废气中S02的含量不得超过0.4mg/L。某兴趣小组利用以下反应:S02+I2+2H20=H2S04+2HI,测定某工业废气中S02的含量,测试装置如图所示。
测试步骤:
①碘溶液的配制:准确称取l.27g碘单质,加入少量碘化钾,先溶解在100mL水中,继续加水配制成l000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液。
③把l00mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。

然后缓缓向外拉,使吸入试管内的废气与淀粉碘溶液充分接触。每次抽取的气体为l00mL,重复抽取n次,直到溶液的颜色变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)排放到空气中的S02气体主要来自于 燃烧。
(2)步骤②中,5mL溶液中溶有碘单质 mg,滴入淀粉试液后,溶液变为 色。
(3)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色。试计算该废气中S02含量,并判断是否符合排放标准。
食品加工厂在制作馒头等面食时,经常会用到食用小苏打。与工业制取碳酸氢钠不同,食用小苏打是由纯碱溶液和二氧化碳反应制得:CO2 + H2O + Na2CO3 === 2NaHCO3。
某温度下,向121.2g碳酸钠溶液中通入一定量的CO2至碳酸钠恰好完全反应,反应后的溶液中有碳酸氢钠析出,过滤,分别得到23.96g固体和106.04 g溶液。
请计算:(1)参与反应的CO2质量。
(2)过滤后的溶液中,碳酸氢钠与水的质量比。
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图,发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O
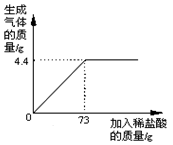
(1)生成CO2的质量为 g。
(2)计算该样品中含碳酸钠的质量分数是多少?(计算结果保留一位小数)
有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气。现将2.5g氧化铜与24.5g氯酸钾的混合物充分加热,残余固体经冷却、称量、质量为17.4g。然后将固体溶于65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤、烘干、称量,质量为2.5g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起 作用。
(2)生成的氧气为 克。
(3)所得滤液中溶质是 ,其质量分数为 。
(4)向所得滤液中加入质量分数为16%的AgNO3溶液恰好完全反应,需AgNO3溶液的质量为多少克?(列出必要的计算过程)
小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量分数。取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,得到了如图所示的曲线关系。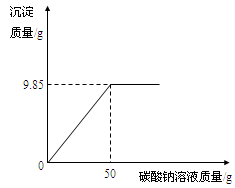
技术员给小红的提示:
①反应的化学方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl
②水的密度:1g/cm3,求产品中氯化钠的质量分数。
计算题 某纯净的天然碱可看做二氧化碳和氢氧化钠反应的产物。取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量的浓硫酸、过量澄清石灰水后,浓硫酸增重0.9g,澄清石灰水中生成沉淀1g。
(1)充分加热后,剩余固体重 g;
(2)该天然碱成份中除含有碳酸钠外,还含有 (填化学式);
(3)6.64g天然碱中,含碳酸钠的物质的量为 mol;
(4)该天然碱的化学式为 。
铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s) g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq) mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。
计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(6分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体,在标准状况下的体积为11.2 L。
计算:(1)产生的NO、 NO2体积各为多少升?
(2)待气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶
液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为多少?
有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?(4分)
(2)通过计算确定该有机物的分子式。(4分)