(本题共14分)工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为 (保留两位小数)。
某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留两位小数)。
一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数。
合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H2 2CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。
 n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算: 燃烧热为283KJ/mol。相同条件下,若2 molCH4燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
燃烧热为283KJ/mol。相同条件下,若2 molCH4燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是 CO、CH4组成的混合气体在b ml O2中完全燃烧后,恢复到原温度和压强。
CO、CH4组成的混合气体在b ml O2中完全燃烧后,恢复到原温度和压强。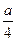 ml,则a与b关系的数学表达式是
ml,则a与b关系的数学表达式是 0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。 粤公网安备 44130202000953号
粤公网安备 44130202000953号