取50.0 ml Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66 g,并有气体放出.试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度.
(2)产生的气体在标准状况下的体积.
用98%的浓H2SO4(ρ=1.84g/cm3)配制成1.84mol/L的稀H2SO4 500ml,计算所需浓H2SO4的体积。(注意:要求写出简单的计算步骤。)
已知可逆反应:M(g)+N(g)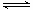 P(g)+Q(g);△H>0,
P(g)+Q(g);△H>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)="2" mol·L-1,a= 。
(4)若反应温度不变,反应物的起始浓度为:c(M)="c(N)=" bmol·L-1,达到平衡后,M的转化率为 。
由等质量的锌片、铜片组成的Zn—Cu—H2SO4原电池,工作一段时间后,锌片的质量减少了2.6g。求:
(1)生成氢气的体积(标准状况);
(2)若将电解质溶液改为硫酸铜溶液,当电池两极的质量差为12.9 g时,从电池中流出的电子数目。
将标准状况下的67.2LHCl气体溶于水,得到200mLHCl溶液。问①HCl的物质的量浓度为多少? ②再将这200 mLHCl溶液加水稀释到3 mol/L,则此时溶液的体积为多少?
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
把5.1 g镁铝合金的粉末放入过量的300 mL 2 mol·L-1盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝和镁的物质的量之比。
(2)在反应后的溶液中加入4 mol·L-1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是
2P+5H2SO4(浓)==2H3PO4+5SO2↑+2H2O
若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目。
(2)计算生成的SO2在标准状况下的体积。(写出计算过程)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
请回答下列问题:
(1)求参加反应的二氧化锰的质量。
(2)求反应中被氧化的HCl的物质的量。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,求该浓盐酸中HCl的物质的量浓度。
常温下,要将质量分数为10%的氯化钠溶液100g变为质量分数为20%的氯化钠,常用的方法有加入溶质和蒸发溶剂。请通过计算回答:
⑴需要加入氯化钠晶体g。
⑵需要蒸发掉g水。
把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为
4.6mol/L(溶液体积变化忽略不计).
求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
由某气态烃和气态单烯烃组成的混合物, 22.5,取在标准状况下的此混合气体4.48L,通入溴水中,结果溴水增重2.1g,通过计算回答:
(1)混合气由哪两种烃组 成;
成;
(2)它们的体积百分比各是多少?
(3)写出该烃发生聚合反应的化学方程式。
(8分)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl中的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积。