(12分)2006年6月,我国海域发生2次红潮事件,这与洗涤剂的使用有关。通常洗涤剂中含有三磷酸五钠(Na5P3O10)。洗涤衣物的废水如直接排放到河湖中会造成水质富营养化,促使藻类大量繁殖,藻类死亡后经氧化,消耗水中的氧气,造成水中缺氧致使河水变黑变臭,鱼类等水生生物因缺氧而死亡。
(1)经测定知,某藻类的组成为:含C 35.76%,含O 49.50%,含N 6.310%,含H 7.370%,含P 0.870%,计算该藻类中各元素原子个数比(相对一个P原子) ________。
(2)藻类被氧气完全氧化的化学方程式(藻类用“化学式”表示,生成物除O外都为最高价化合物)为_____________________________。
(3)现有一个面积为1×106 m2、深20 m的湖泊,含氧量为9.1 g/m3,若每天排入3%(质量分数)三磷酸五钠的废水1 000 kg,多少天后湖里的氧气被耗尽(设空气中的氧气不再溶入湖水中)。
有一种可溶性氯化物、溴化物、碘化物的混合物,对其进行如下测定:
①称取试样5.00 g,溶于水后加入足量AgNO3溶液,使卤离子完全沉淀为卤化银,质量为3.57 g。将该卤化银加热并通入氯气使AgBr、AgI完全转化为AgCl后,其质量变为2.87 g。
②称取试样15.00 g,溶于水后加入氯化亚钯(PdCl2)处理后,其中只有碘化物转化为PdI2沉淀,该沉淀的质量为2.16 g。
请完成下列问题:
(1)步骤①称取的试样中,所有卤原子的物质的量之和是_____________mol,该试样中碘原子的物质的量是______________mol。
(2)列式计算原混合物中溴的质量分数和氯的质量分数
将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为 (
( ≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成
≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成 体积的CO2(
体积的CO2( 、
、 均为标准状况时的体积)。
均为标准状况时的体积)。
(1)Y的主要成分是_________(写化学式)。
(2)求原混合物中NaOH的NaHCO3的物质的量之比。
(9分)用下列数据求氧原子的电子亲和能
Mg(s) Mg(g) ΔH1="141" kJ·mol-1
Mg(g) ΔH1="141" kJ·mol-1
Mg(g) Mg2+(g) ΔH2="2" 201 kJ·mol-1
Mg2+(g) ΔH2="2" 201 kJ·mol-1 O2
O2 O(g) ΔH3="247" kJ·mol-1
O(g) ΔH3="247" kJ·mol-1
Mg2+(g)+O2-(g) MgO(s) ΔH4="-3" 916 kJ·mol-1
MgO(s) ΔH4="-3" 916 kJ·mol-1
Mg(s)+ O2(g)
O2(g) MgO(s) ΔH5="-602" kJ·mol-1
MgO(s) ΔH5="-602" kJ·mol-1
(14分)Ⅰ.恒温、恒压下,在一个可变容积的密闭容器中发生如下反应:
A(g)+B(g) C(g)
C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成a mol C,这时A的物质的量为____ mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__________ mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别是y mol和3a mol,则x="__________" mol,y="__________" mol。平衡时,B的物质的量__________(选填一个编号)。
A.大于2 mol B.等于2 mol
C.小于2 mol D.可能大于、等于或小于2 mol
作出此判断的理由是__________。
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是_______。
Ⅱ.若维持温度不变,在一个与I反应前起始体积相同且容积固定的容器中发生上述反应。
(5)开始时放入1 mol A和1 mol B,达到平衡后生成b mol C,将b与(1)小题中的a进行比较____________(选填一个编号)。
A.a<b B.a>b C.a="b " D.不能比较a和b的大小
作出此判断的理由是________________________________________________________。
(12分)向20 mL HCl和H2SO4的混合溶液中逐滴加入0.1 mol·L-1的Ba(OH)2溶液,生成沉淀的质量和溶液的pH与加入的Ba(OH)2溶液体积的关系如图5所示。试完成下列问题:
图5
(1)起始时,混合酸中硫酸的物质的量浓度为______________ mol·L-1。
(2)起始时,混合酸中盐酸的物质的量浓度为______________ mol·L-1。
(3)B点表示的沉淀的质量为______________g。
(4)A点表示溶液中的[H+]为______________ mol·L-1,pH为______________。
(5)C点的pH为______________(pH可直接用对数表示)。
某温度下,将一定量密度为1.15 g·cm-3的NaCl溶液用石墨电极通电电解,设NaCl恰好完全反应,且无其他反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比。
(2)求原NaCl溶液的物质的量浓度。
在1青团L含0.001 mol·L-1 SO 的溶液中,注入0.01 mol·L-1BaCl2,能否使SO
的溶液中,注入0.01 mol·L-1BaCl2,能否使SO 沉淀完全?〔已知Ksp(BaSO4)=1.08×10-10〕
沉淀完全?〔已知Ksp(BaSO4)=1.08×10-10〕
某学生准备用质量分数为37%、密度为1.19 g·cm-3的浓盐酸配制0.10 mol·L-1的稀盐酸500 mL。请完成下列问题:
(1)量取浓盐酸的体积为_________ mL,应选用量筒的规格为_________ mL。
(2)配制时应选用容量瓶的规格为_________ mL。
(3)需用的仪器有:容量瓶、___________、___________、___________和试剂瓶等。
吗啡和海洛因都是严格查禁的毒品。吗啡分子中C、N、H的质量分数依次为:71.58%、4.91%、6.67%,其余是氧。
(1)通过计算得出吗啡的相对分子质量(不超过300)为________________;吗啡的分子式是_________________________。
(2)已知海洛因是吗啡的二乙酸酯。则海洛因的相对分子质量是_____________;分子式是_____________。
一种称为“摇头丸”的毒品已从国外流入我国,严重损害一些吸毒者的身心健康,司法机关予以坚决查缉和打击。已知该毒品中氮的质量分数为10.37%,试完成下列问题:
(1)“摇头丸”的分子结构可能是( )

(2)据①中“摇头丸”的分子结构分析,处于同一平面上的碳原子至少有( )
A.6个 B.7个 C.8个 D.9个
(3)固体“摇头丸”属于( )
A.分子晶体 B.原子晶体
C.离子晶体 D.金属晶体
(4)摇头丸在一定条件下能否与浓HNO3发生硝化反应?(填“能”或“不能”)______________。
(5)写出 “摇头丸”在加热加压和有催化剂时跟H2反应的方程式:_____________________。
(6)“摇头丸”能否跟浓盐酸反应?若能,写出生成物的结构简式;若不能,请说明理由__________________________________________________________。
(6分)某蛋白质含氮16.8%,现欲测定该蛋白质水溶液的浓度,做了如下实验:
(1)取该蛋白质溶液0.5 mL,用含催化剂的热硫酸处理,使蛋白质中的有机氮全部转变为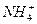 ;
;
(2)然后用强碱溶液处理,并用10.00 mL 0.020 mol·L-1的盐酸吸收逸出的全部氨气;
(3)再用0.010 mol·L-1的氢氧化钠溶液中和未反应的盐酸,消耗氢氧化钠溶液5.00 mL。
求:每毫升该蛋白质溶液含有多少毫克蛋白质。
有NaCl和NaI的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为17.55 g。求原混合物中氯化钠的质量分数。