将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为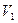 (
(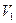 ≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成
≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成 体积的CO2(
体积的CO2(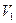 、
、 均为标准状况时的体积)。
均为标准状况时的体积)。
(1)Y的主要成分是_________(写化学式)。
(2)求原混合物中NaOH的NaHCO3的物质的量之比。
将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为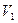 (
(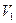 ≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成
≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成 体积的CO2(
体积的CO2(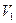 、
、 均为标准状况时的体积)。
均为标准状况时的体积)。
(1)Y的主要成分是_________(写化学式)。
(2)求原混合物中NaOH的NaHCO3的物质的量之比。