水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
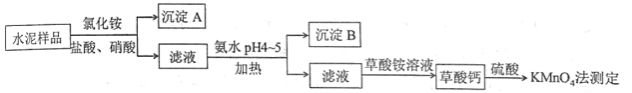
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
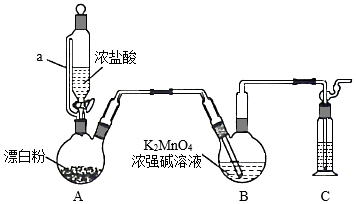
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42﹣+2H2O═2MnO4﹣+MnO2↓+4OH﹣
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 酸式 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用c mol•L﹣1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4•2H2O(M=126g•mol﹣1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. 3时,样品中一定不含杂质
B. 越大,样品中H2C2O4•2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:
(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.75.7% | C.30.0% | D.80.6% |
用NA表示阿伏加德罗常数,下列有关说法正确的是
| A.在常温常压下,11.2LN2含有的分子数小于0.5NA |
| B.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| C.将1 L2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D.46g NO2和N2O4混合气体所含氧原子数有可能为3NA |
下列物理量与所对应的单位不正确的是
| A.n:mol | B.M:g.mol-1 | C.Vm,:L.mol-l | D.NA:个 |
下列各组实验中溶液最先变浑浊的是()
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |
用 NA 表示阿伏伽德罗常数的值,下列叙述正确的是()
| A.22.4LCO2 与足量的 Na2O2 反应时,转移的电子数为 NA 个 |
| B.0.1mol 铁在 0.1molCl2 中充分燃烧,转移的电子数为 0.2NA 个 |
C.对于反应:A(g)+B(g)  C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 |
| D.Zn -H2SO4-Cu 原电池中,当电路中有 NA 个电子通过时,溶液的质量增加 1g |
NA表示阿伏伽德罗常数的值,下列说法中正确的是
| A.常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
| B.0.1mol/L的NaHSO4溶液中含有阳离子的物质的量为0.2mol |
| C.7.8gNa2S和7.8gNa2O2中含有的阴离子 数目均为0.1NA |
| D.1.8g18O2分子与1.8g18O3分子中含有的中子数不相同 |
与50 mL 0.2 mol / L NH4Cl溶液中的NH4+浓度相同的是
| A.50 mL 0.2 mol / L CH3COONH4溶液 |
| B.50 mL 0.25 mol / L (NH4)2SO4溶液 |
| C.100 mL 0.2 mol / L NH4NO3溶液 |
| D.50 mL 0.2 mol / L NH3·H2O |
在一支25ml的酸式滴定管中盛入0.1mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.l mol·L-1NaOH溶液进行中和,则所需NaOH溶液的体积
| A.大于20 mL | B.小于20 mL | C.等于20 mL | D.等于5mL |
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )
| A.标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023 mol-1 |
| B.28g乙烯所含共用电子对数目为4×6.02×1023 mol-1 |
| C.1mol 苯中含有碳碳双键的数目为3×6.02×1023 mol-1 |
| D.2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023 mol-1 |
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂。请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
(3) 滴定结果如下表所示:
| 滴定次数 |
待测溶液NaOH的 体积/mL |
标准盐酸溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
30.30 |
| 3 |
25.00 |
0.22 |
26.31 |
若盐酸标准溶液的浓度为0.1000 mol·L-1,则该NaOH溶液的物质的量浓度为_________ mol·L-1。
把3.9 g Na2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计)。