水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
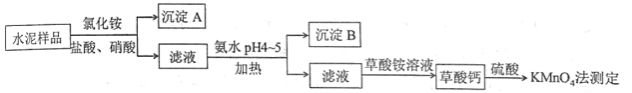
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
NA表示阿伏伽德罗常数的值,下列说法中正确的是
| A.常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
| B.0.1mol/L的NaHSO4溶液中含有阳离子的物质的量为0.2mol |
| C.7.8gNa2S和7.8gNa2O2中含有的阴离子 数目均为0.1NA |
| D.1.8g18O2分子与1.8g18O3分子中含有的中子数不相同 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
下列关于容量瓶的使用方法中,正确的是
| A.使用前检查是否漏水 | B.溶液未冷却即注入容量瓶中 |
| C.容量瓶可长期存放溶液 | D.在容量瓶中直接溶解固体 |
NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.18gD2O和18gH2O中含有的质子数均为10NA |
| B.200mL1mol/LAl2(SO4)3溶液中,Al3+和SO42-离子总数为NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl﹣,则SO42﹣为
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.4 mol/L |
设NA为阿伏加德罗常数的数值.下列说法正确的是
| A.1mol甲苯含有6NA个C﹣H键 |
| B.18g H2O含有10NA个质子 |
| C.标准状况下,22.4L氨水含有NA个NH3分子 |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A.标准状况下,1 L庚烷所含有的分子数为NA/22.4 |
| B.1 mol甲基(—CH3)所含电子数为9NA |
| C.标准状况下,B2H6(g)和C2H4的混合气体22.4 L,所含的电子数约为16NA |
| D.26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
下列叙述正确的是
| A.NaCl的摩尔质量是58.5g |
| B.将40g氢氧化钠溶解在1L水中可配制物质的量浓度为1mol/L的氢氧化钠溶液 |
| C.气体摩尔体积指lmol任何气体所占的体积约为22.4L |
| D.10毫升1mol/L氯化铝溶液与50毫升3mol/L氯化钠溶液中所含氯离子物质的量浓度相等 |
实验室欲用Na2CO3﹒10H2O晶体配制1mol/L的Na2CO3溶液100mL,下列说法正确的是
| A.要完成实验需称取10.6gNa2CO3﹒10H2O晶体 |
| B.本实验需用到的仪器是天平、药匙、玻璃棒、烧杯、100mL容量瓶 |
| C.定容时俯视刻度线会导致浓度偏高 |
| D.配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 |
设NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,22.4L H2O所含的分子数为NA |
| B.由CO2和O2组成的混合物共有NA个分子,其中的氧原子数为2NA |
| C.0.5 mol·L-1的Ba(OH)2溶液中OH-的数目为NA |
| D.1molNa2O2与足量的CO2反应转移2NA个电子 |
下列叙述中,正确的是(NA代表阿伏加德罗常数)
| A.0.1 mol NH4+中,含有的质子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.常温、常压下,22 g CO2中含有的氧原子数为NA |
| D.0.5 mol/L Na2SO4溶液中,含有的离子总数为1.5NA |
配制一定体积、一定物质的量浓度溶液时,下列操作会使所配溶液浓度偏小的是( )
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时俯视观察液面 |
| D.胶头滴管加水时,有少量水滴到容量瓶外 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.标准状况下,22.4LH2O含有的分子数NA |
| B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA |
| C.通常状况下, NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中含有Cl-数目为NA |