下列化学用语表述错误的是( )
| A. |
的电子式: |
| B. |
中子数为
的氧原子: |
| C. |
分子的
模型: |
| D. |
基态
原子的价层电子排布图: |
中华文化源远流长,化学与文化传承密不可分。下列说法错误的是( )
| A. |
青铜器“四羊方尊”的主要材质为合金 |
| B. |
长沙走马楼出土的竹木简牍主要成分是纤维素 |
| C. |
蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化 |
| D. |
铜官窑彩瓷是以黏土为主要原料,经高温烧结而成 |
某废水处理过程中始终保持 饱和,即 ,通过调节 使 和 形成硫化物而分离,体系中 与 关系如图所示, 为 和 的浓度,单位为 。已知 ,下列说法正确的是( )
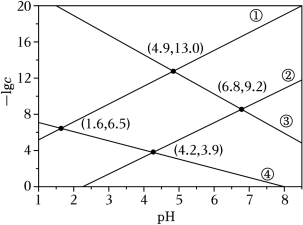
| A. |
|
| B. |
③为 与 的关系曲线 |
| C. |
|
| D. |
|
晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
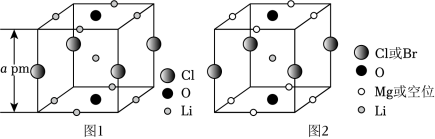
| A. |
图1晶体密度为 |
| B. |
图1中 原子的配位数为 |
| C. |
图2表示的化学式为 |
| D. |
取代产生的空位有利于 传导 |
某小组进行实验,向
蒸馏水中加入
,充分振荡,溶液呈浅棕色,再加入
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知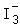 为棕色,下列关于颜色变化的解释错误的是( )
为棕色,下列关于颜色变化的解释错误的是( )
|
选项 |
颜色变化 |
解释 |
|
A |
溶液呈浅棕色 |
在水中溶解度较小 |
|
B |
溶液颜色加深 |
发生了反应: |
|
C |
紫黑色晶体消失 |
的消耗使溶解平衡 右移 |
|
D |
溶液褪色 |
与有色物质发生了置换反应 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
一定条件下,酸性 溶液与 发生反应, (Ⅱ)起催化作用,过程中不同价态含 粒子的浓度随时间变化如图所示。下列说法正确的是( )

| A. |
(Ⅲ)不能氧化 |
| B. |
随着反应物浓度的减小,反应速率逐渐减小 |
| C. |
该条件下, (Ⅱ)和 (Ⅶ)不能大量共存 |
| D. |
总反应为: |
某低成本储能电池原理如图所示。下列说法正确的是( )
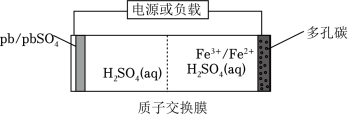
| A. |
放电时负极质量减小 |
| B. |
储能过程中电能转变为化学能 |
| C. |
放电时右侧 通过质子交换膜移向左侧 |
| D. |
充电总反应: |
某工厂采用如图工艺制备 ,已知焙烧后 元素以 价形式存在,下列说法错误的是( )
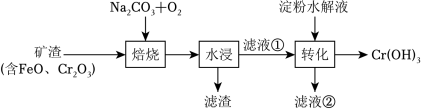
| A. |
“焙烧”中产生 |
| B. |
滤渣的主要成分为 |
| C. |
滤液①中 元素的主要存在形式为 |
| D. |
淀粉水解液中的葡萄糖起还原作用 |
某种镁盐具有良好的电化学性能,其阴离子结构如图所示。 是核电荷数依次增大的短周期元素, 原子序数之和等于 , 原子价电子数是 原子价电子数的 倍。下列说法错误的是( )
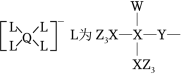
| A. |
与 的化合物为极性分子 |
| B. |
第一电离能: |
| C. |
的氧化物是两性氧化物 |
| D. |
该阴离子中含有配位键 |
冠醚因分子结构形如皇冠而得名,某冠醚分子 可识别 ,其合成方法如图。下列说法错误的是( )
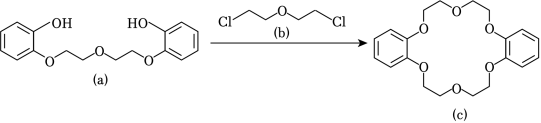
| A. |
该反应为取代反应 |
| B. |
均可与 溶液反应 |
| C. |
核磁共振氢谱有 组峰 |
| D. |
可增加 在苯中的溶解度 |
某无隔膜流动海水电解法制 的装置如图所示,其中高选择性催化剂 可抑制 产生。下列说法正确的是( )
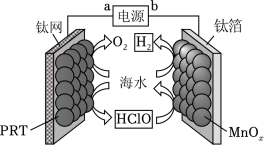
| A. |
端电势高于 端电势 |
| B. |
理论上转移 生成 |
| C. |
电解后海水 下降 |
| D. |
阳极发生: |
在光照下,螺吡喃发生开、闭环转换而变色,过程如图。下列关于开、闭环螺吡喃说法正确的是( )
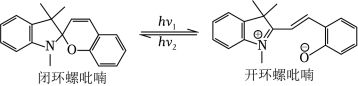
| A. |
均有手性 |
| B. |
互为同分异构体 |
| C. |
原子杂化方式相同 |
| D. |
闭环螺吡喃亲水性更好 |
我国古代四大发明之一黑火药的爆炸反应为: 。设 为阿伏伽德罗常数的值,下列说法正确的是( )
| A. |
含 键数目为 |
| B. |
每生成 转移电子数目为 |
| C. |
晶体中含离子数目为 |
| D. |
溶液中含 数目为 |
下列鉴别或检验不能达到实验目的是( )
| A. |
用石灰水鉴别 与 |
| B. |
用 溶液检验 是否变质 |
| C. |
用盐酸酸化的 溶液检验 是否被氧化 |
| D. |
加热条件下用银氨溶液检验乙醇中是否混有乙醛 |