(10分)现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称:
(1)写出各有关物质的名称:
| A._________________, | B._________________ | C._________________, | D._________________,E._________________。 |
(2)写出加入的试剂:
a._____________,b._____________。
(3)写出有关的操作方法:
①_____________,②_____________,③_____________。
实验室配制500 mL 0.5 mol·L-1的稀硫酸溶液,有如下操作步骤:①把量取好的浓硫酸放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液立即小心地转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度1—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)应该量取____________________mL 18.4 mol·L-1浓硫酸。
(2)上述步骤中第___________步不恰当,正确的操作是:___________________________。
(3)实验操作步骤的正确顺序为(填序号):_______________________________。
(4)本实验用到的玻璃仪器有:__________________________________________。
(5)若出现如下情况,对所配溶液浓度将有何影响?没有进行操作④:________________。加蒸馏水时不慎超过了刻度:____________________。定容时俯视读数:______________。
(6)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度:______________。向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面:__________________。
除去下列物质中的杂质,根据需要填空。(每空1分,共8分)
| 物质 |
杂质 |
选用试剂 |
离子方程式 |
| NaCl |
Na2SO4 |
|
|
| KCl |
K2CO3 |
|
|
| NaCl |
MgCl2 |
|
|
| Na2SO4 |
NaHSO4 |
|
|
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
1、步骤⑤的方法是 用到的主要仪器是:
2、检验碘的存在可以用 试剂,现象是 。
碘的用途有 。
⑴写出下图石油的蒸馏装置中所指仪器的名称:
a._________ ___ b._________
⑵指出右图石油的蒸馏装置中的错误之处:
①缺铁圈和
②缺 (防液体暴沸)
③
④
Ⅰ.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:

请根据题目要求回答下列问题:
(1)趁热过滤的目的是 。
(2)加入过量A,溶液中发生的离子方程式有 。
(3)结晶操作过程中应控制滤液酸性的原因是 ,结晶析出晶体后,用过滤的方法从溶液得到晶体,洗涤晶体的实验操作是 。
(4)实验室利用硫酸亚铁溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出该反应的离子方程式 。
Ⅱ.草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。

(5)该装置中最不合理的部分__________(填字母),原因是__________________________。
(6)写出B、C处的现象___________________________________________。
(7)当72.0g FeC2O4·2H2O完全反应后,残留混合物质量为27.2g,无水硫酸铜增重14.4g,C装置增重22.0g。求残留混合物的成分和物质的量 。(假设每个实验装置的药品足量,气体被充分吸收)
(8分) 从右边选项中选择适当的试剂除杂,把相应的字母填写在表格内。
| 物质(括号内为杂质) |
答案 |
除杂试剂 |
||||
| (1) CO2气体(SO2) |
|
|
||||
| (2) CH4气体(CH2=CH2) |
|
|||||
| (3) Na2CO3固体(NaHCO3) |
|
|||||
| (4) FeCl2溶液(FeCl3) |
|
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:]
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
为证明草本灰的主要成分是K2CO3,设计如下实验:
(1)提取碳酸钾晶体,可供选择的实验操作步骤有:
| A.过滤; | B.溶解; | C.浓缩结晶; | D.蒸发;E.冷却结晶;F.萃取;G.蒸馏。按照操作顺序,应选择___________(写编号),在实验中都要用到的仪器是___________。 |
(2)鉴定提取的晶体是碳酸钾______________________________________________。
某学生设计了下述实验室分馏石油的实验,分为五个步骤。
①将蒸馏烧瓶放在铁架台上,在蒸馏烧瓶上塞好带温度计的橡胶塞。
②连接好冷凝管,把冷凝管固定在铁架台上,将冷凝管的一端和水龙头连接,将出水口一端的橡胶管放入水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度调整铁圈的高度,放好石棉网。
④向蒸馏烧瓶中放入碎瓷片,再用漏斗向烧瓶中加入原油,塞好带温度计的塞子,将牛角管接在冷凝管的末端,并深入锥形瓶中。
⑤检查气密性(利用给固定装置微热的方法)。
正确的操作顺序是( )
| A.②①③⑤④ |
| B.②③①⑤④ |
| C.①②③④⑤ |
| D.⑤④③②① |
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。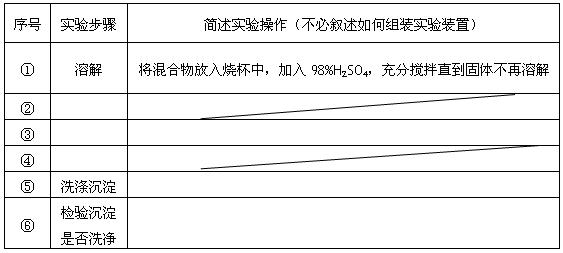
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
⑴第1步:灼烧。操作是将足量海带放到 灼烧成灰烬。
A.试管 B.瓷坩埚
⑵第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用 充分搅拌,煮沸, 。(填操作名称)
⑶第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用 。(填代号)A.新制氯水 B.H2O2 C.KMnO4溶液
理由是 。
⑷第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: __ 。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
(5)把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。
。
某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成。请完成对该白色粉末成分的探究:
限选实验仪器:药匙、试管、单孔塞、导管、玻璃棒、滴管、带铁夹的铁架台。
限选实验试剂:1 mol·L-1H2SO4、3%H2O2、澄清石灰水、品红试液。
(1)提出合理假设
假设1:该白色粉末成分为亚硫酸钠;
假设2:该白色粉末成分为碳酸钠;
假设3: 。
(2)设计实验方案证明(1)的假设
(3)实验过程
根据(2)的实验方案,进行实验。写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1:检查装置气密性(略) |
|
| 步骤2: |
|
| 步骤3: |
|