某待测溶液中可能含有Fe2+、Fe3+、Al3+、Ag+、Ba2+、 、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
根据实验结果:
(1)判断待测液中有无Ba2+、Ca2+,并写出理由____________________。
(2)写出沉淀D的化学式__________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:____________________。
(8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂: a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO
分离方法:①.分液 ②.过滤 ③.洗气 ④.蒸馏
| 混合物 |
需加入的试剂 |
分离方法 |
| 溴苯(溴) |
|
|
| 乙烷(乙烯) |
|
|
| 乙醇(水) |
|
|
| 乙酸乙酯(乙酸) |
|
|
实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、BaCl2、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。请回答下列问题:
已知:
①取少量样品于试管中,加水振荡,未见沉淀生成:
②通过元素分析仪器的检测,得知该样品中不含K元素;
③用下图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)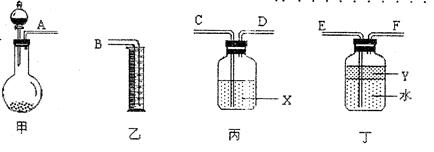
(1)按气流从左到右方向,正确的连接顺序为:A接____, 接 , 接B。
(2)利用所组装置,由分液漏斗向烧瓶中滴加l0mL水,理论上将排入量筒中 mL液体。
(3)液体X是 ,其作用是 。
(4)Y的作用是防止产生的气体溶于水,下列历给试剂符合要求的是____(填序号)。
A.甲苯 B.四氯化碳 C.酒精 D.浓硫酸
若称取样品3.00g,加入10.0mol/L的硫酸至过量(共5mL),产生无色气体,排入量筒中液体的体积为229mL(已折算成标准下的状况)。根据此信息,回答以下问题:
(5)对实验获得准确的气体体积无益的操作有 (填序号)
①检查装置的气密性:
②实验结束后,将连通ZJ、丁的导管中的水也引入量筒;
③读数时视线与量筒内凹液面最低相切点水平;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平;
⑤在甲装置胶塞上再连接一个导管,通入N2将系统中SO2全部排出。
(6)向充分逸出气体后的溶液中加入过量BaCl2溶液,得到白色沉淀13.98g。根据实验所得现象及数据,可知:样品中Na2SO3的质量分数是 ,含有的杂质是 。
(1)下面A~F是中学化学实验中常见的几种仪器:
A.坩埚 B.容量瓶 C.试管 D.托盘天平 E.玻璃棒
① 其中仪器上标示出仪器的使用温度的 __________(填写编号);
②称取 10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为____ g.
(2)若要配制500mL 1mol/L NaOH溶液时,下列哪些操作会使实验结果偏高的是 ,偏低 ,无影响 。(填写编号)
A.定容,振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未使用游码)
C.原容量瓶洗涤后未干燥
D.定容时俯视刻度线
E.移液时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中
为了检验和除去下表中的各种所含的杂质(括号里的物质),请从(I)中选出适当的
检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物 质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
|
|
| 酒 精(水) |
|
|
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 |
(II)除杂试剂:a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): 
(1)按照该同学设计的实验步骤,并不能得到精盐,原因在于步骤中少了一个操作,该操作是 ,应加在 和 之间。
(2)判断BaCl2已过量的方法是( )
| A.取②后的上层清液少许放入试管中,再滴入几滴Na2SO4溶液,若溶液未变浑浊,则证明BaCl2已过量。 |
B.取②后的上层清液少许放 入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则证明BaCl2已过量。 入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则证明BaCl2已过量。 |
| C.取②后的上层清液少许放入试管中,再滴入几滴AgNO3溶液,若溶液变浑浊,则证明BaCl2已过量。 |
| D.取②后的上层清液少许放入试管中,再滴入几滴BaCl2溶液,若溶液变浑浊,则证明BaCl2已过量。 |
(3)写出④中相应的离子方程式 , 。
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
(1)选择适当的试剂除去下列物质中的少量杂质(括号内为杂质):
溴苯(溴):试剂______,反应方程式_________________________;
甲烷(乙烯):试剂______,反应方程式_________________________;
(2)选择合适的试剂鉴别下列物质:
苯和甲苯:试剂__________________________________;
乙烷和乙炔:试剂_____________________________________。
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填字母即可)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、蒸发结晶 |
(1)除去 CaCl2溶液中悬浮的 CaCO3 ;
(2)从碘水中提取碘 ;
(3)用自来水制取蒸馏水 ;
(4)分离植物油和水 ;
(5)除去 NaCl 中所含的少量 KCl ;
如图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题: v
v
⑴图中两处明显的错误是:
, 。
⑵ A仪器的名称是 ,B仪器的名称是 。
⑶实验时A中除加入适量自来水外,还需加入少量 ,其作用是 。
(17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。
(3)实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验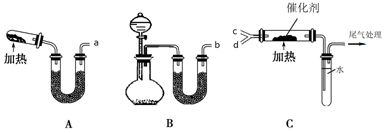
用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。
下图所示是分离混合物时常用的仪器及实验室硫酸试剂标签,回答下列问题:
(1)写出仪器C、E的名称 、
(2)分离以下混合物应该主要选用使用什么仪器?( 填字母符号)
填字母符号)
粗盐和泥沙: 花生油和水:
(3)计算标签上硫酸的物质的量浓度为 
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是__ ______。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_________;Ⅳ发生反应的化学方程式为________;Ⅴ中的试剂为_____________ 。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为___ _____,原因是___ _______________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为_________ _______。
NaCl中混有少量的硝酸钾,要除去硝酸钾,所用的方法是___________________,汽油和水的混合物分离的方法是____________