明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为 。
(3)请你写出验证溶液1中有NH4+的实验过程:_______________________________________________。
(4)实验室用Fe2O3与CO反应来制取单质Fe。

①请按气流由左到右的方向连接下列各装置,顺序为A→ 。
②检查装置A气密性的方法是 。
③在点燃B处的酒精灯前,应进行的操作是_______________________________________;④装置C的作用是________________。
含苯酚的工业废水的方案如下图所示:
回答下列问题:
(1)设备①进行的是 操作(填写操作名称),实验室这一步操作所用的仪器是 。
(2)由设备②进入设备③的物质A是 。
(3)在设备③中发生反应的化学方程式为 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是 。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加入的试剂的名称及作用。
| 选用的仪器 |
加入试剂 |
加入试剂的作用 |
| C |
H2O2溶液与MnO2 |
产生氧气 |
| |
|
|
| |
|
|
| D |
CuO粉末 |
将可能生成的CO转化为CO2 |
| |
|
|
| |
|
|
| |
|
|
(2)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。
主要实验步骤如下:
①按照图示组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量为b g
④从分液漏斗滴入6 mol·L-1的稀硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列问题:
(1)装置中干燥管B的作用是_____________________________________。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测量的结果将________(填“偏高”、“偏低”或“不变”)。
(3)步骤⑤的目的是________________________________________。
(4)步骤⑦的目的是_______________________________________________。
(5)试样中纯碱的质量分数为________________(用含a、b、d的代数式表示)。
醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g); 2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)检查虚框内装置气密性的方法是 。
(2)醋酸钠溶液应放在装置 中(填写装置编号,下同);盐酸应放在装置 中;
装置4的作用是 。
(3)本实验中所有配制溶液的水需煮沸,其原因是 。
(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是 阀门A、 阀门B (填“打开”或“关闭”)。
(5)本实验中锌粒须过量,其原因是 。
(6)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4。某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:

试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是 、 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中的 、 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、 。
(4)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是 。
(5)写出第②、③步涉及的两个化学反应的离子方程式: 、 。
某研究性小组同学在学习相关有机基础知识后,决定试用类似制乙酸乙酯的装置,以环己醇为主要原料制备环己烯。
已知: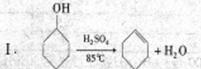
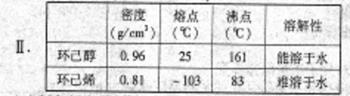
(1)制备粗产品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。请回答有关问题:
①A中碎瓷片的作用是_______________,导管B除了导气外还具有的作用是____________;
②试卷C置于冰水浴中的目的是_______________.
(2)制备精品
①环己烯粗品长含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用_______________(填写编号)洗涤;
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,温度应控制在______℃左右,实验制得的环己烯制品质量低于理论产量,可能的原因是______________________.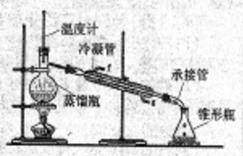
草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的CO32-、SO42-和Cl-。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在SO42-。③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl-。其中,加入足量Ba(NO3)2溶液的目的是 。
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
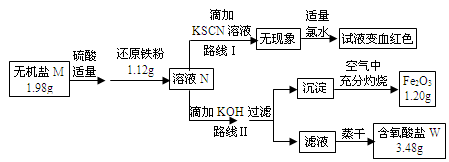
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
天然海水中含有非常丰富的化学元素,具有很大的利用价值。工业上对海水资源综合利用的部分工艺流程如下图所示。
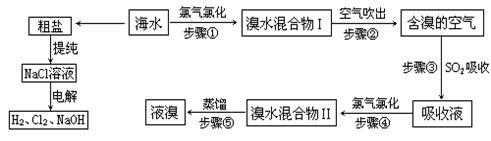
(1)请列举海水淡化的两种方法: 、 。
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入少量二氧化碳发生反应的离子方程式 。
(3)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如上图。步骤①反应的离子方程式是 ;步骤③通入二氧化硫的目的是 ,其反应的化学方程式是 。
(4)步骤⑤蒸馏的过程中,温度应控制在80-90℃。温度过高或过低都不利于生产,请解释其原因: 。
常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量。查阅资料得知:

一种常用的分析试剂 EDTA二钠盐(用Na2H2Y•2H2O表示)可用于测定Ca2+,其反应为:
Ca2++H2Y2-===CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色。于是该实验小组做了如下实验:
步骤一:配制待测溶液。取适量补钙片研碎后,准确称取0.400 g配成250 mL溶液。
步骤二:滴定。用移液管取待测液25.00 mL于锥形瓶中,加入适量NaOH溶液,摇
匀,再加入铬黑T指示剂3滴,用0.0100 mol•L−1EDTA二钠盐溶液滴定至终点。
三次重复滴定平均消耗EDTA二钠盐溶液22.50 mL。
请回答下列问题:
(1)步骤一中补钙剂要用2 mol/L的盐酸溶解,反应的离子方程式为__________________,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____→____(填下列操作的序号)。
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为_______。
(3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗
铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.7500g试样中加入100.00 mL 0.1200mol/mol KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.1000mol/molFeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000mol/molNa2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2 2I-+S4O62-),消耗14.00 mL。
2I-+S4O62-),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=___________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将___________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
氯化铁是常见的水处理剂。某氯化铁(FeCl3·6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3·6H2O的质量分数,实验按以下步骤进行:
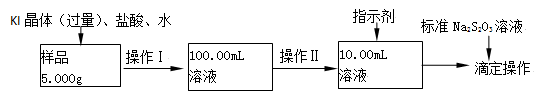
已知有关离子方程式为:2Fe3+ +2I-==2Fe2++ I2 , I2+2S2O32-==2I- +S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻液体呈现红褐色,反应的离子方程式为: 。
(2)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(3)操作Ⅱ必须用到的仪器是 (选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
(4)指示剂是淀粉溶液,则达到滴定终点的现象是 。
(5)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3 溶液18.17mL。该样品中FeCl3·6H2O的质量分数为 。
(6)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是 (选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
B.[实验化学]茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华。另外茶叶中还含有11% ~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿。现从茶叶中提取咖啡碱流程如下:
步骤I:称取一定量的茶叶,放入下图所示提取器的滤纸筒中,在圆底烧瓶中加入95%乙醇,用水浴加热,连续提取1.5小时。
步骤Ⅱ:待冷凝液刚刚虹吸下去时,立即停止加热。稍冷后,改成蒸馏装置,回收提取液中的大部分乙醇。
步骤Ⅲ:趁热将瓶中的残液倾入蒸发皿中,拌入3 ~ 4g生石灰粉使成糊状,低温蒸干,并压碎块状物。
步骤Ⅳ:取一只口径合适的玻璃漏斗,罩在隔以刺有许多小孔滤纸的蒸发皿上,小心加热升华,控制温度在180℃左右。当滤纸上出现大量白色毛状结晶时,停止加热,使其自然冷却,收集升华所得咖啡因。
回答下列问题:
(1)实验之前需要将茶叶研磨成粉末状,其目的是 。
(2)溶解抽提时不选择氯仿直接将咖啡碱提取而选用乙醇的原因是 。
(3)提取器中虹吸管的作用是 。
(4)冷凝器中冷却水从 进 出(选填“a”或“b”)。
(5)生产过程中可循环使用的物质是 。
(6)在粗产品中加入生石灰的原因是 。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 |
实验现象 |
结论 |
| 步骤1:在滤液A中加入 |
|
滤液A中有Fe3+ |
| 步骤2:在滤液A中加入 |
|
滤液A中有Fe2+ |
(2)步骤④中煮沸的作用是: ;
(3)步骤③中反应的离子方程式为: ;
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式。(写出计算过程)