贵州省贵阳市普通高中高三年级8月摸底考试化学试卷
以“改革驱动,走向生态文明新世代”为主题的生态文明贵阳国际论坛2014年7月在贵阳召开,本次年会确定以植树造林增加碳汇的方式,实现“碳中和”目标。下列行为与此次目标不相符的是
| A.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,以提高空气质量 |
| B.开发时能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料 |
| C.大力开采煤、石油和天然气,以满足经济发展的需要 |
| D.大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放 |
近两年来,“雾霾”一直是人们所关注的对象,下图为雾霾的主要成分示意图。下列说法不正确的是( )
| A.SO2和NxOy溶于水均只生成酸 |
| B.重金属离子可导致蛋白质变性 |
| C.苯是最简单的芳香烃 |
| D.大量燃烧化石燃料时造成雾霾天气的一种重要因素 |
俄罗斯科学家用铪和钨两种核素精确确定了地球和月球的年龄,得出月球至少比地球早700万年形成。它们是根据 和
和 两种核素的含量比例得出的。下列有关
两种核素的含量比例得出的。下列有关 和
和 关系的说法正确的是
关系的说法正确的是
| A.中子数相等 | B.原子质量几乎相同 |
| C.互为同位素 | D.在周期表中处于相邻位置 |
当光束通过下列分散系,能观察到丁达尔现象的是( )
①有尘埃的空气 ②稀盐酸 ③蒸馏水 ④墨水
| A.②③ | B.①④ | C.③④ | D.①②③④ |
下列关于C、Si、Ge、Sn、Pb的比较,正确的是( )
A.它们的最外层电子数随核电荷数增加而增多
B.它们的最高价氧化物均可溶于水生成相应的酸
C.它们单质的氧化性随核电荷数的增加而逐渐减弱
D.它们的氢化物的稳定性随核电荷数的增加而逐渐增强
下列关于 说法中正确的是( )
说法中正确的是( )
A. 可用于判断所有条件下的反应能否自发进行 可用于判断所有条件下的反应能否自发进行 |
B. 只用于判断温度、体积一定的反应能否自发进行 只用于判断温度、体积一定的反应能否自发进行 |
C. 只用于判断温度、压强一定的反应能否自发进行 只用于判断温度、压强一定的反应能否自发进行 |
D. <0的反应,在该条件下一定剧烈反应 <0的反应,在该条件下一定剧烈反应 |
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
| A.3.2g由O2和O3组成的混合物中含有氧原子的数目为0.2NA |
| B.0.1mol苯中含有碳碳双键的数目为0.3 NA |
| C.标准状况下,11.2L三氯甲烷中含有分子的数目为0.5 NA |
| D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4 NA |
下列实验方案中,可达到预期目的的是( )
| A.用萃取的方法分离Br2和CCl4混合物 |
| B.加足量烧碱溶液过滤,出去混在镁粉中的少量铝粉 |
| C.加入盐酸酸化的Ba(NO3)2溶液,可以鉴别Na2SO3和Na2SO4 |
| D.用溶解、过滤的方法分离KNO3和NaCl的混合物 |
关于如图所示装置的叙述正确的是( )
| A.甲乙装置中的铜片都作正极 |
| B.甲乙装置中的溶液内的H+均在锌片上被氧化 |
| C.甲乙装置中锌片上发生的反应都是还原反应 |
| D.甲装置中铜片上有气泡生成,乙装置中的铜片质量减小 |
某有机物的结构简式为HO-CH2CH= CHCH2-COOH,该有机物不可能发生的化学反应为( )
| A.水解 | B.酯化 | C.加成 | D.氧化 |
在密闭容器中A与B反应生成C,其反应速率分别为 、
、 、
、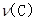 表示。已知: 2
表示。已知: 2 =3
=3 ,3
,3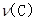 =2
=2 ,则此反应可表示为( )
,则此反应可表示为( )
| A.2A+3B=2C | B.A+3B="2C" | C.3A+B="2C" | D.A+B=C |
下列用于解释实验事实的化学方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-= Al(OH)3 |
| B.纯碱溶液使酚酞变红:CO32-+2H2O⇌H2CO3+2OH- |
C.乙酸清除水垢后的化学反应原理:2H++CO32-= CO2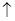 + H2O + H2O |
| D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+ |
下图所示为验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。试验时先将浓硫酸滴入装有亚硫酸钠固体的培养皿中。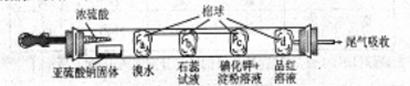
则下列关于此实验现象,解释或结论以及对应关系均正确的是( )
贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
| A.反应①中Se是氧化产物,I2是还原产物 |
| B.反应②中浓H2SO4是氧化剂,SeO2是还原产物 |
| C.反应①中每有1.0mol I2生成,转移电子数目为4 NA |
| D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2 |
已知25。C时,下表为几种常见物质的溶度积常数;下列有关说法不正确的是( )
| 化学式 |
溶度积常数 |
化学式 |
溶度积常数 |
| Ag2S |
6.3×10-50 |
AgCl |
1.8×10-10 |
| CuS |
4.3×10-36 |
AgBr |
5.4×10-13 |
| FeS |
6.3×10-18 |
AgI |
8.3×10-17 |
A.除去工业废水中的Cu2+可以选用Na2S作沉淀剂
B.将AgCl、AgBr和AgI饱和溶液等体积混合后,再加入足量的浓AgNO3溶液,首先析出AgI沉淀
C.Ag2S、CuS、FeS溶解度依次增大
D.将FeS加入较浓的CuSO4溶液中,会有CuS生成
Fe2O3、ZnO、CuO的固体粉末a克,在加热条件下用足量CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀,则a的数值为( )
| A.7.41 | B.3.59 | C.3.21 | D.2.46 |
工业制氢气的一个重要反应是:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
①C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) ="==" CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①以下反应能说明CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
| A.容器中CO的含量保持不变 | B.容器中CO2浓度与CO浓度相等 |
C. (CO)= (CO)= (H2O) (H2O) |
D.容器中混合气体的平均相对分子质量保持不变 |
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时 ___________
___________ (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
砷(As)广泛分布与自然界,砷与氮同主族,比氮多两个电子层。
(1)砷位于元素周期表中_____周期________族,其气态氢化物的稳定性比NH3_______(填“强”或“弱”);
(2)砷的常见酸性氧化物有As2O3和As2O5,请根据图中信息写出As2O3分解为As2O5的热化学方程式:________________________;
(3)已知:将酸滴入砷酸盐与KI混合的溶液中发生反应:AsO43-+2I―+2H+=AsO33-+I2+H2O.某研究性学习小组同学欲利用该反应原理,设计实验装置探究原电池原理,请你配合他们绘制原电池装置图,并回答下列问题:
若以石墨为电极,正极上发生的反应为______________.该电池工作时,当外电路中转移5mol电子时,则有_________molI2生成.
(10分)海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_____________(填序号);
| A.Cl2 | B.淡水 | C.烧碱 | D.粗盐 |
(2)下图是从海水中提取镁的简单流程。
工业上常用于沉淀 Mg2+的试剂A的名称是__________,,Mg(OH)2转化为MgCl2离子方程是_________海水经蒸发浓缩析出NaCl晶体后的溶液成为卤水,卤水中含有NaBr等无机盐,某实验小组同学设计如下实验流程,模拟工业上从卤水提取工业溴。
①操作I中所涉及到的离子反应方程式为____________.
操作II中所涉及到的化学反应方程式为____________.
②操作II用SO2水溶液吸收Br2,吸收率可达95%,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_____________.
③实验小组的同学通过实验发现,如果用未经浓缩的海水直接与Cl2反应,生成的Br2的量会大幅度降低,请你根据所学知识分析原因:_______________________________________.
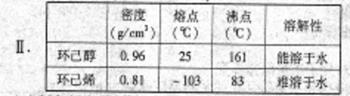
某研究性小组同学在学习相关有机基础知识后,决定试用类似制乙酸乙酯的装置,以环己醇为主要原料制备环己烯。
已知: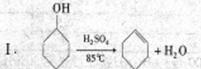
(1)制备粗产品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。请回答有关问题:
①A中碎瓷片的作用是_______________,导管B除了导气外还具有的作用是____________;
②试卷C置于冰水浴中的目的是_______________.
(2)制备精品
①环己烯粗品长含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用_______________(填写编号)洗涤;
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,温度应控制在______℃左右,实验制得的环己烯制品质量低于理论产量,可能的原因是______________________.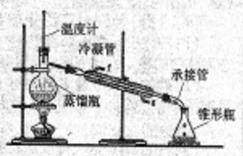
(6分)下图是某化学兴趣小组同学模拟石蜡油(液态烷烃混合物)深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程:
请回答下列问题:
(1)A的结构简式为_________________;(2)B中所含官能团的名称是___________________;
(3)写出下列反应的化学方程式:
①B+丙烯酸 丙烯酸乙酯___________ ②苯
丙烯酸乙酯___________ ②苯 硝基苯____________________
硝基苯____________________
碳是形成化合物种类最多的元素。
(1)CH2=CH-C≡N是制备腈纶的原料,其分子中 键和
键和 键的个数之比为__________(填最简整数比);
键的个数之比为__________(填最简整数比);
(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是____________________;
(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_______________.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的___________区;
(2)氟的电子排布图为___________________;
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是______________;
(4)已知碘酸HIO3和高碘酸H5IO6的结构分别如图I、图II所示:
请比较二者酸性强弱:HIO3_________H5IO6(填“>”“<”或“=”);
(5)下图为碘晶体晶胞结构。下列说法中正确的是_________.
| A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以8配位数交替配位形成层状结构 |
| B.用均摊法可知平均每个晶胞中有4个碘原子 |
| C.碘晶体为无限延伸的空间结构,是原子晶体 |
| D.碘晶体中存在的相互作用有非极性键和范德华力 |
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种非0族元素组成,其原子个数比为14:4:5:1:1.其中A是元素周期表中原子半径最小的元素,C、D元素同主族且原子序数D为C的二倍,E元素的原子外圈电子排布为(n-l)dn+6nsl。 请回答下列问题:
(1)元素D在周期表中的位置是____________________;
(2)该配位化合物的化学式为____________________;
(3)A元素可分别与B、C、D元素化合形成三种电子数相等的分子,它们分别为________;其中A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为_____________;
(4)EDC4常作电镀液,其中DC42-的空间构型是________.其中D原子的杂化轨道类型是_____________;
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61 10-8cm,则E的密度为______________________.
10-8cm,则E的密度为______________________.
根据下列信息回答问题。
(1)请用系统命名法对 ,命名:_____________;
,命名:_____________;
(2)HO(CH2)3COOH发生缩聚反应后所得缩聚物的结构结构简式:____________;
(3)一定条件下某烃M与H2按物质的量之比1:2加成生成C2H5C(CH3)3,则烃M的结构简式为_____________.
(5分)质谱、红外光谱、核磁共振氢谱等物理方法已成为研究有机物的重要手段。
(1)下列物质中,其核磁共振氢谱只有一个吸收峰的是__________;
A. CH3CH3 B.CH3COOH C.CH3COOCH3 D.苯酚
(2)化合物A中各原子数目比为:n(C):n(H):n(O)=1:2:1,对化合物A进行质谱分析得到下图甲所示的质谱图,则A的分子式为___________,其中所含官能团的名称为_________;
(3)化合物B和C的分子式都是C2H4Br2,B的核磁共振氢谱如下图乙所示,则B的结构简式为____________.请预测C的核磁共振氢谱上应该有_________个吸收峰。
有机物A(( ))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
请回答下列问题:
(1)有机物A不能够发生的反应有:_________(填写字母)
A. 取代反应 B. 加成反应 C. 消去反应 D. 酯化反应
(2)可与1mol 有机物C反应的NaOH的物质的量最多可为___________
A. 1mol B. 2mol C. 3mol D. 4mol
(3)1mol A与E可在浓硫酸作用下脱去2mol H2O,写出该反应的化学方程式:________________;
(4)E在高温、高压和催化剂作用下反应生成高分子化合物HPMA,写出该反应的化学方程式:________;
(5)H是G的一种同分异构体。0.1mol H与足量金属Na反应放出3.36L氢气(标准状况下),0.1mol H足量NaHCO3反应放出2.24LCO2(标准状况下),H能发生银镜反应。H的结构简式可能是:____________、________________.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号