现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:
有关氢氧化物完全沉淀的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
6.7 |
8.0 |
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取 措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是 。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式 。
(5)从滤液中提取NaNO3晶体的操作步骤为 。
(6)在实验室如何洗涤过滤出的碱式碳酸锌? 。
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图: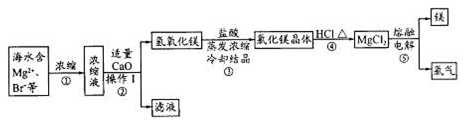
根据上述流程图,回答下列问题:
(1)操作I的名称是 。
(2)步骤中②反应的化学方程式为 。
(3)步骤④中加热时通入HCl气流的作用是 。
(4)步骤⑤的离子反应方程式为 。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。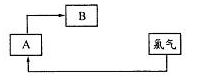
碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。
请回答:
(1)步骤①中灼烧海带用到的实验仪器是______________________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤③的实验操作是_______________________。
(3)步骤④中反应的离子方程式是_____________________________________。
(4)步骤⑤中,可以选择的有机溶剂是__________________(填序号)。
a. 乙酸 b. 四氯化碳 c. 酒精 d. 苯
(5)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: __________________________________________________________________________。
(6)因过量的Cl2会与I2反应,所以步骤④中加入的氯水应保持适量。为证明此说法,某同学做如下实验:取少量碘水,滴加氯水,观察到碘水逐渐褪色,经检验生成物含有IO3-。该反应的化学方程式是_________________________________。
实验是化学的基础。下图为一化学实验装置图,图中,夹持仪器已略去,用“△”表示用酒精灯加热。
请仔细观察该实验装置图,回答问题:
(1)甲装置通入空气的导气管插入乙醇中的主要目的是
(2)乙装置用揉乱的铜丝,好处是
(3)乙装置的化学反应反应方程式为 ,反应中,转移电子的数目是 若有23g乙醇发生反应,至少需要通入标准状况下的空气 L
(4)写出一种检验反应产物的方法及现象
(5)该反应还可以用更简便的方法实现:取一束铜丝在酒精灯上加热,铜丝变黑,趁热插入盛有少量乙醇的试管中,铜丝又变红;如此反复多次即可。请写出实验中发生反应的化学方程式 。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作名称 ① ③
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
| A.乙酸 | B.苯 | C.四氯化碳 | D.酒精 |
| 有机试剂 |
酒精 |
四氯化碳 |
苯 |
乙酸 |
| 毒性 |
无 |
无 |
有 |
无 |
| 水溶性 |
与水以任意比互溶 |
与水互不相溶 |
与水互不相溶 |
与水以任意比互溶 |
NaCl在生活、生产和科研中都有广泛的用途。
I. 从海水中提取的粗盐含有Ca2+、Mg2+、SO4-等离子,为制备精盐可使用以下四种试剂:①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液 ④盐酸(用于沉淀的试剂均稍过量)。
(1)加入试剂的合理顺序是________(填选项)。
a. ①②③④ b. ③①②④ c. ②①③④ d. ③②①④
(2)加入过量Na2CO3溶液的作用是________________。
II. 实验室要配制100 mL 0.2 mol·L-1 NaCl溶液。
(1)用托盘天平称氯化钠固体的质量是________g。
(2)配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(3)下列操作中,可能造成所配制溶液的浓度偏低的是________(填选项)。
a. 没有洗涤烧杯和玻璃棒 b. 定容时,俯视刻度线
c. 洗涤后的容量瓶中残留少量蒸馏水
Ⅰ:选择一种试剂鉴别下列各组物质,将所选试剂的化学式或名称写在横线上:
① 苯、甲苯 ② 苯、硝基苯、乙醇
③ 苯酚溶液、己烯、己烷、醋酸溶液
Ⅱ:为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计如下甲、乙两方案。
方案甲:
实验1:取少量无水乙醚于试管中,加入少量金属钠。
实验2:各取3mL无水乙醚于试管中,分别加入少量等物质的量的苯酚和乙醇,再投入大小相同的钠块。
方案乙:
各取少量等物质的苯酚和乙醇于试管中,均在60℃的水浴加热,待苯酚熔化后,各放入相同大小的一小块金属钠。(已知:苯酚的密度为1.07g/mL)
(1)方案甲设计实验1的目的是 。
(2)方案乙中观察到:在乙醇中,钠很快与乙醇反应产生气体,溶液保持澄清;在苯酚中,钠块表面有少量气泡,且表面产生白色悬浮物,最后白色悬浮物充满苯酚熔融液。
①实验中观察到的白色悬浮物为 ;
②苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其可能原因有____________、_____________。
海洋植物如海带、马尾藻等含有丰富的碘元素,实验室从海带中提取碘的流程如下:
(1)提取碘的过程中有关实验的操作名称① ② ③ ④
(2)写出过程②中有关反应的离子方程式 ;
该反应中氧化剂是 ,氧化产物是 。
(3)提取碘的过程中,可选择得有机试剂是 ;
| A.酒精 | B.水 | C.四氯化碳 | D.甘油 |
在碘水中加入上述有机试剂,振荡静置,可观察到的现象是
海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:
① ;③______________________。
写出实验②中有关反应的离子方程式 _______________________ 。
(2)提取碘的过程中,可供选择的有关试剂是___________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,甘油 |

(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:① ② ③ 。
(4)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
Ⅰ.下列有关操作正确的是 _。
①FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯
②将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验
③用Cu和Ag作为两极,H2SO4溶液作为电解质溶液,可以构成原电池
④为了防止自来水管生锈,一般在表面镀上一层Zn
⑤使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀
A.②④ B.①② C.③⑤ D.④⑥
Ⅱ. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用
是: 。
(2)已知下表数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/(g/cm3) |
| 乙醇 |
-144 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
—— |
338 |
1.84 |
①按装置图安装好仪器后,需要试剂为3 ml 乙醇,2 ml乙酸,适量浓硫酸,请选择合适的加入顺序 。
A. 先加浓硫酸,再加乙醇,最后加乙酸
B. 先加乙醇,再加浓硫酸,最后加乙酸
C. 先加乙酸,再加浓硫酸,最后加乙醇
D. 先加浓硫酸,再加乙酸,最后加乙醇
②根据上表数据分析,为什么乙醇需要过量一些,其原因是 。
(3)按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
①写出加入的试剂名称: 试剂(a)是 ;试剂(b)是 。
②写出有关的操作分离方法:①是 ,②是 ,③是 。
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口。静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:__________________________________。
(2)采用水浴加热的原因是__________________________________________________。
(3)反应时铁屑过量的目的是(用离子方程式表示)____________________________。
(4)溶液趁热过滤的原因是__________________________________________________。
(5)塞紧试管口的目的是____________________________________________________。
(6)静置冷却一段时间后,在试管中观察到的现象是____________________________。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)实验室制备乙烯的反应方程式是:
(2)I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV 。(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(3)能说明SO2气体存在的现象是 。(4)使用装置II的目的是 。
(5)使用装置III的目的是 。(6)确定含有乙烯的现象是 。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子中官能团的名称是__________________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为________________,反应类型是________________________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
某溶液中可能含有Na+,NH4+,Ba2+,SO42-,I一,SO32-中的几种,已知各离子浓度均为0.1mol/L,且溶液呈电中性。取样品分别进行实验:
①用pH试纸检测,溶液显弱酸性;
②加溴水,再加淀粉溶液均无明显现象;
据此推断该溶液中含有的离子为 。
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。
I、II、III、IV装置可盛放的试剂是:I: II: III:
IV: (请将下列有关试剂的序号填入空格内)
| A.品红 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是 ;
使用装置II的目的是 ;
使用装置III的目的是 ;
确定含有乙烯的现象是 。