[四川]2014届四川省成都市高三上学期摸底测试化学试卷
如图为酸雨的形成示意图,相关说法不正确的是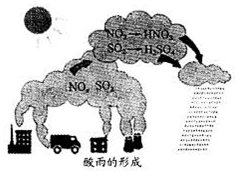
| A.HNO3、H2SO4均有腐蚀性 |
| B.酸雨的pH:5.6≤pH≤7 |
| C.汽车尾气中含NO |
| D.工业尾气中的SO2、NO2的应回收利用 |
下列物质中有三种具有某一相同的化学性质,则不属于这三种物质之列的是
| A.Na2O2 | B.KMnO4 | C.HNO3 | D.Na2SO4 |
某实验兴趣小组用如图所示装置实验,其中描述不合理的是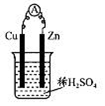
| A.Zn为负极 |
| B.H+向负极定向移动 |
| C.化学能转化为电能 |
| D.Cu电极反应:2H++2e-=H2↑ |
对下列实验现象的描述不正确的是
| A.光亮的金属Na暴露在空气中,表面逐渐变暗 |
| B.将SO2通入品红溶液,品红溶液褪色 |
| C.将Mg(OH)2固体投入FeCl3溶液中,无明显现象 |
| D.浓硫酸与Cu混合加热,可能有白色固体析出 |
下列有关说法正确的是
A.含有18个中子的氯原子: |
B. 的名称是2—甲基—3—丁烯 的名称是2—甲基—3—丁烯 |
C.化合物 是苯的同系物 是苯的同系物 |
| D.乙醇分子中的C—O键可在红外光谱中发生振动吸收 |
已知2—氨基丙酸铵结构如图,下列叙述正确的是
| A.该物质中只含有共价键 |
| B.—NH2可以与H2O形成氢键 |
| C.该物质难溶于水 |
| D.该物质的晶体属于分子晶体 |
某化学兴趣小组对废铁屑做如图所示的处理。相关分析正确的是
| A.滤液的溶质是Fe(NO3)2 |
| B.该实验中发生的反应都为氧化还原反应 |
| C.沉淀X为Fe(OH)2 |
| D.沉淀X受热分解得到Fe2O3 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B.常温常压下,22.4L CH4含有4NA个C—H共价键 |
| C.2mol N2与2mol H2混合充分反应,转移的电子数目为4NA |
| D.10L pH=1的硫酸溶液中含有的H+离子数为2NA |
下列反应中产生气泡速率最快的是
| |
温度 |
浓度 |
催化剂 |
| A |
25℃ |
2mL5%H2O2 |
0.1mol/LFeCl32滴 |
| B |
35℃ |
2mL8%H2O2 |
MnO2粉末 |
| C |
25℃ |
2mL5%H2O2 |
MnO2粉末 |
| D |
25℃ |
2mL8%H2O2 |
0.1mol/LCuCl22滴 |
用下列实验装置进行相应实验,能达到实验目的的是
| A.用图1所示装置分离有机层和水层 |
| B.用图2所示装置从食盐水中提取NaCl |
| C.用图3所示装置用水来吸收HCl |
| D.用图4所示装置收集并检验氨气 |
关于柠檬醛的说法不正确的是
| A.该物质存在顺反异构体 |
| B.该物质的分子式为C10H18O |
| C.该物质可以发生银镜反应 |
| D.1mol该物质最多消耗3molH2 |
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如表中所示。下列判断不正确的是
| |
Y |
W |
| X |
Z |
|
A.原子半径最大的是X B.电负性最大的是W
C.Y、Z原子序数差为8 D.氢化物最稳定的是Z
下列反应的离子方程式正确的是
A.将氯气溶于水制备次氯酸:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
| B.少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
| C.Na2O2与H2O混合:2Na2O2+2H2O=4Na++4OH-+O2↑ |
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
下列有机反应属于取代反应的是
| A.CH3CH2OH遇炽热CuO | B.用新制Cu(OH)2检验葡萄糖 |
| C.戊烷与氯气混合光照 | D.苯与足量的氢气反应 |
常温,相应条件下,下列各组离子一定能大量共存的是
| A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH- |
| B.无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
C. =1×1014的溶液:Ba2+、Na+、SO32-、NO3- =1×1014的溶液:Ba2+、Na+、SO32-、NO3- |
| D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl- |
已知5 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为 |
B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
现有室温下两种溶液,有关叙述正确的是
| 编号 |
① |
② |
| pH |
12 |
2 |
| 溶液 |
氢氧化钠溶液 |
醋酸溶液 |
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度:c(NaOH)﹥c(CH3COOH)
C.两种溶液等体积混合后:c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D.加水稀释相同倍数后:c(Na+)﹥c(CH3COO-)
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L |
| B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) |
| D.原溶液中c(Br-)=0.4mol/L |
反应I2+I- I3-达到平衡时c(I3-)与温度的关系如图所示。
I3-达到平衡时c(I3-)与温度的关系如图所示。
下列说法正确的是
| A.图中反应进行到状态D时,一定有v逆>v正 |
| B.A点和B点的化学平衡常数相同 |
| C.对B点溶液升高温度时,该反应△v正>△v逆 |
| D.增大KI溶液浓度有利于I2的溶解 |
Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为 ;铝的化合物明矾可用于净水,其原理用离子方程式解释为 。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是 。
②步骤II中涉及铝元素的离子方程式为 ;
③步骤III中能否用HCl代替CO2? (填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为 ;向该滤液中滴加少量NaOH溶液,则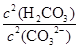 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因 。
高分子G是常用合成材料,可通过下列路线合成。已知F的质谱图中最大质荷比为86,其中C、H、O的原子个数之比为2:3:1,F在酸性条件下水解可生成碳原子数相同的两种有机物D和E。
请回答下列问题:
(1)B的分子式为 ,F分子含氧官能团的名称为 。
(2)G的结构简式为 。
(3)反应①、⑥的反应类型均是 。
(4)反应②的化学方程式为 。
(5)已知: ,则E的结构简式为 。
,则E的结构简式为 。
(6)在F的同分异构体中,核磁共振氢谱有三个峰,三个峰的面积之比为1:1:1,任意写出其中一种满足上述条件的结构简式 。
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E2+的核外电子排布式为 。
(2)CB32-的立体构型是(用文字描述) ;其中心原子的杂化轨道类型为 。
(3)根据等电子原理,AB分子的电子式为 ;其中σ键与π键之比为 。
(4)[E(H2O)6]3+内E3+与H2O间的作用力为 。
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为 ;为了尽可能多地实现 向
向 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+ 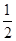 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s |
0 |
2 |
3 |
4 |
| c(NO)/mol·L-1 |
1.00×10-3 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 |
|
 |
 2.70×10-3 2.70×10-3 |
|
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图: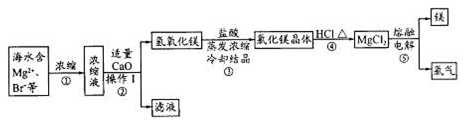
根据上述流程图,回答下列问题:
(1)操作I的名称是 。
(2)步骤中②反应的化学方程式为 。
(3)步骤④中加热时通入HCl气流的作用是 。
(4)步骤⑤的离子反应方程式为 。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。
某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为 。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为 ,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为 g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。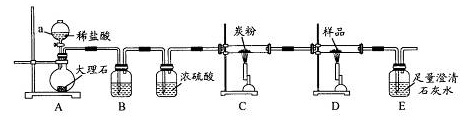
B中的溶液是 ;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为 ;实验装置中有一明显缺陷是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号