有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
(1)根据上述实验填空:
(1)写出B、D的化学式:B ____,D 。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为__ _。
(3)C常用作净水剂,用离子方程式表示其净水原理____ ___。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为_ ___。
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0.78g沉淀,则E溶液的物质的量浓度可能是 moI/L。
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
(1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(2)固体E的成分为 ____,加入的试剂④为 __,
发生的化学方程式为 。
(3)加入试剂①的目的是 ____________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为 、冷却结晶 、 、洗涤、干燥。
(5)若废水中硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液,其中c(Cu2+)=0.1 mol/L,c(Fe2+)=0.4 mol/L,
c(SO42-)= 0.6 mol/L,已知氢离子浓度忽略不计,则c(Na+)为________。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ |
Na+ |
Cu2+ |
Al3+ |
| 阴离子 |
SO42- |
HCO3- |
NO3- |
OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)写出A溶液与E溶液反应的离子方程式: 。
(3)C常用作净水剂,用离子方程式表示其净水原理 。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为 。
(5)向C溶液中加入过量E溶液,反应的离子方程式为 。
(6)向100mL 1.0mol/LC溶液中加入1.0mol/LE溶液,若要使生成沉淀质量最大,则加入E的体积为 mL。
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO 、SO42-、CO32-,六种化合物的阴阳离子均不相同,且均易溶于水。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
、SO42-、CO32-,六种化合物的阴阳离子均不相同,且均易溶于水。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
写出下列六种化合物的化学式:
A 、B 、C 、D 、E 、F 。
【化学——选修2:化学与技术】
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。

(3)用苦卤(含 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下:

①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下: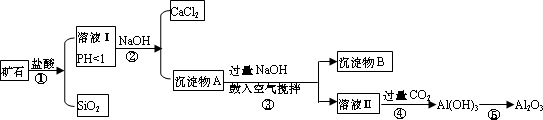
(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有__________________;
(2)步骤③中NaOH参加反应的离子方程式____________________________,鼓入空气并充分搅拌的目的是(用化学方程式表示)____________________;
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是_____________________。
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阳极的主要电极反应式是________________。在阴极附近加入无色酚酞,看到的现象是__________________。淡水的出口为________(填“a”“b”或“c”)。

(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
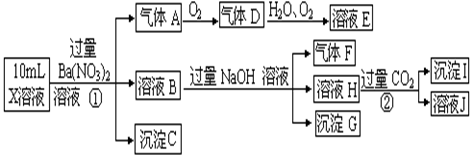
(1)上述离子中,溶液X中除H+外还一定含有的离子是 ,不能确定的阴离子是 ,若要用实验证明该离子存在,其化学方法是 ;
(2)写出下列反应的离子方程式:
①中生成气体A: ,
②生成沉淀I: 。
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.06mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。
某溶液仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+Ag+Mg2+Cu2+Al3+NH4+ |
| 阴离子 |
Cl-CO32- NO3- SO42-I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有_______,阴离子有______;并据此推测原溶液应该呈______性,原因是________________(用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下: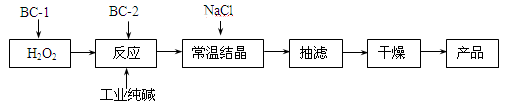
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 (填写序号)。
| A.饱和氯化钠溶液 | B.水 | C.异丙醇 | D.碳酸钠饱和溶液 |
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol/LNa2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。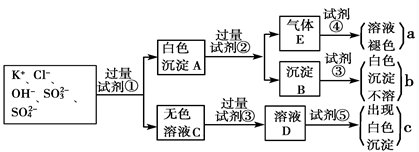
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
已知在含HNO3的溶液中放入Al不生成H2;某无色溶液里,只含有下列11种离子中的几种:Mg2+、Fe3+、H+、Ag+、Ba2+、SO42-、HCO3-、OH-、MnO4-、NO3-、CO32-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。试回答:
(1)若溶液跟铝反应只有AlO2-生成,则原溶液一定含有的大量的物质是________(填化学式),发生反应的离子方程式是_____________________________________________________,还可能含有的较多的物质是__________________(填化学式)。
(2)若溶液跟铝反应后有Al3+生成,则原溶液中可能(包括一定能)大量存在的离子是_____________。