四川省攀枝花市高一(下)学期调研检测化学试卷
下列有关环境保护与绿色化学的叙述不正确的是
| A.形成酸雨的主要物质是硫的氧化物和氮的氧化物 |
| B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气 |
| C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
| D.水华、赤潮等水体污染主要是由含氮、磷的污水任意排放造成的 |
海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是
| A.食盐 | B.钠 | C.溴 | D.碘 |
下列常见金属的冶炼原理中不合理的是
| |
金属 |
冶炼原理 |
| A |
Fe |
 |
| B |
Hg |
 |
| C |
Al |
 |
| D |
Mg |
 |
下列化学用语的书写,正确的是
A.氯气的电子式: |
B.硫原子的结构示意图: |
C.溴化钠的电子式: |
D.质量数为37的氯原子37 17Cl |
下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6 |
| C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
下面有关晶体的叙述中,不正确的是
| A.氯化钠晶体中,每个Na+周围紧邻6个Cl- |
| B.氯化铯晶体中,每个CS+周围紧邻8个Cl- |
| C.氟化钙晶胞中,每个F-周围紧邻8个Ca2+、每个Ca2+周围紧邻8个F- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
下列各含氧酸中,酸性最强的是
| A.HMnO4 | B.H2SeO3 | C.H3BO3 | D.H3PO4 |
下列关于F、Cl、Br、I的比较,说法正确的是
| A.原子最外层的电子数随核电荷数的增加而增多 |
| B.简单阴离子的还原性随核电荷数的增加而增强 |
| C.氢化物的稳定性随核电荷数的增加而增强 |
| D.非金属性随核电荷数的增加而增强 |
下列反应的离子方程式正确的是
| A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-="=" BaSO4↓+H2O |
| B.稀碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- ="=" CO32- + H2O |
| C.氯化铝溶液中滴加过量氨水:Al3+ + 3NH3·H2O="=" Al(OH)3↓+ 3NH4+ |
| D.常温下,将铜片加入稀硝酸中:Cu + 2H+ ="=" Cu2+ + 2H2↑ |
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
| A.由极性键构成的极性分子 | B.由非极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由极性键构成的非极性分子 |
氯化溴(BrCl)结构和性质类似Br2、Cl2。下列叙述正确的是
| A.BrCl是离子化合物 | B.Br-Cl键长大于Cl-Cl键长 |
| C.BrCl 和Br2中都存在极性键 | D.BrCl和Cl2都是非极性分子 |
下列基态原子或离子核外未成对电子数目为5的是
| A.Fe3+ | B.P | C.Cr | D.Cu |
下列各组分子中,中心原子杂化轨道的类型不相同的是
| A.CO2与SO2 | B.CH4与NH3 | C.SO3与BF3 | D.H2S与CCl4 |
 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
| A.常压下五种元素的单质中,Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物比X的氢化物稳定 |
| D.Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 |
可用下图所示装置制取(必要时可加热)、净化、收集的气体是 
| A.铜与稀硝酸反应制一氧化氮 |
| B.氯化铵与氢氧化钙固体反应制氨气 |
| C.锌和稀硫酸反应制氢气 |
| D.亚硫酸钠固体与硫酸反应制二氧化硫 |
W、X、Y、Z四种短周期主族元素的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是
| A.W、Y、Z的电负性大小顺序一定是Z>Y>W |
| B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C.Y、Z形成的分子的空间构型可能是正四面体 |
| D.WY2分子中δ键与π键的数目之比是2:1 |
将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
按要求回答下列问题:
(1) 用电子式表示H2O的形成过程________________________。
(2) 用电子式表示MgCl2的形成过程________________________。
按要求回答下列问题:
(1)硫酸铜水溶液中含有的水合铜离子化学式为________。向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,生成深蓝色的配合离子化学式为________,再向反应后的溶液中加入乙醇,析出的深蓝色晶体的化学式为________。
(2)试比较 和
和 的沸点高低并说明理由_________。
的沸点高低并说明理由_________。
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。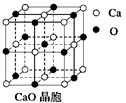
A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大。已知A原子核外有三个未成对电子;B的最外层电子数是内层电子数的3倍;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;R原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点高,理由是 。
(3)基态R+离子的核外电子排布式是 。
(4)Q分子是A2B的等电子体,Q的结构式为 。
(5)图一是R单质的晶胞结构,配位数为 ;图二是B、R两元素组成的一种化合物的晶胞,其化学式为 。

图一 图二
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。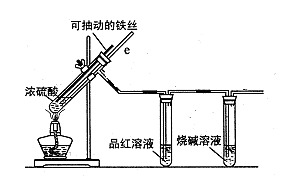
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。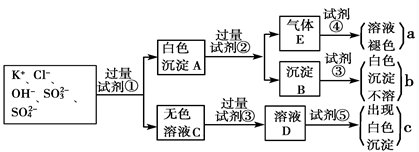
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号