按要求回答下列问题:
(1)硫酸铜水溶液中含有的水合铜离子化学式为________。向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,生成深蓝色的配合离子化学式为________,再向反应后的溶液中加入乙醇,析出的深蓝色晶体的化学式为________。
(2)试比较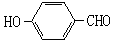 和
和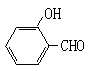 的沸点高低并说明理由_________。
的沸点高低并说明理由_________。
按要求回答下列问题:
(1)硫酸铜水溶液中含有的水合铜离子化学式为________。向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,生成深蓝色的配合离子化学式为________,再向反应后的溶液中加入乙醇,析出的深蓝色晶体的化学式为________。
(2)试比较 和
和 的沸点高低并说明理由_________。
的沸点高低并说明理由_________。