工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________
在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是__________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g,溶液中c(Cl-)= mol/L.。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:
①_____________,②____________,③______________,④________________。
B.请写出通入⑥的化学方程式__________________________________
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: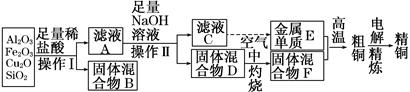
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
有一透明溶液,已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、
HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混和气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(1)淡黄色粉末的名称为 ;
(2)溶液中肯定有 离子,肯定没有 离子,可能有________离子;
(3)写出下列反应方程式
①淡黄色粉末与水反应 ;
②产生刺激性气味气体的离子方程式 ;
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失,反应的离子方程式为 ;
(4)溶液中阳离子的物质的量之比为(H+及没有确定的离子除外) 。
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。
(3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是______________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①是_________;操作②是_________;操作⑤是_________。(填操作名称)
(2)操作②需要的主要玻璃仪器除烧杯外,还需要_________。
(3)加入足量的X、Y、Z是为了除去溶液中的杂质,它们依次是BaCl2溶液 、KOH溶液和 _____溶液。
(4)检验无色溶液B中是否含有SO42-的方法是_________。
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下: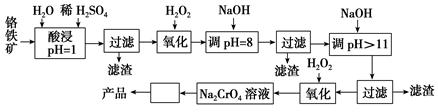
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以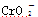 形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
7.6 |
9.0 |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
9.6 |
11.0 |
8 |
9(>9溶解) |
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:__________________、_________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤不能省略,为什么?____________。
(4)流程图中 内的操作是______________________。
内的操作是______________________。
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下: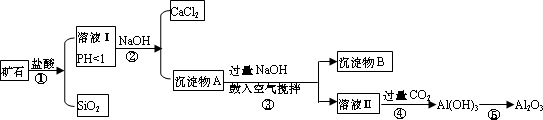
(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有__________________;
(2)步骤③中NaOH参加反应的离子方程式____________________________,鼓入空气并充分搅拌的目的是(用化学方程式表示)____________________;
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是_____________________。
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阳极的主要电极反应式是________________。在阴极附近加入无色酚酞,看到的现象是__________________。淡水的出口为________(填“a”“b”或“c”)。

(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
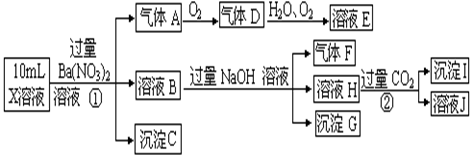
(1)上述离子中,溶液X中除H+外还一定含有的离子是 ,不能确定的阴离子是 ,若要用实验证明该离子存在,其化学方法是 ;
(2)写出下列反应的离子方程式:
①中生成气体A: ,
②生成沉淀I: 。
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.06mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。
某溶液仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+Ag+Mg2+Cu2+Al3+NH4+ |
| 阴离子 |
Cl-CO32- NO3- SO42-I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有_______,阴离子有______;并据此推测原溶液应该呈______性,原因是________________(用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下: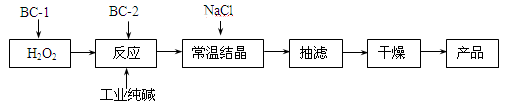
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 (填写序号)。
| A.饱和氯化钠溶液 | B.水 | C.异丙醇 | D.碳酸钠饱和溶液 |
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol/LNa2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。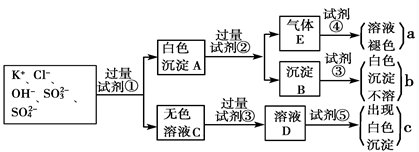
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。