高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下: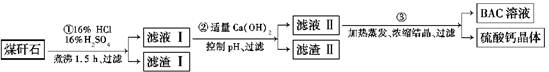
(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式:_______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。
(3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是______________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。
化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如 下:
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。
(4)在实验室里,完成过程④中的____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有___________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是____________________________________________________。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ.有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液后过滤得到的滤渣中主要含有________(填写化学式)。25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(Mg2+)∶c(Fe3+)=________。
(2)操作X为________,其温度应控制在_____________________________________
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由______________________________
________________________________________________________________________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: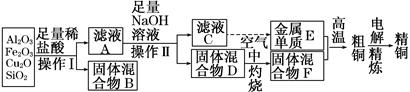
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________________________________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。
工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________
在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号