根据混合物的特点,分离方法一般有过滤、蒸发、蒸馏……,欲把碘从碘水中分离出来,可在溶液中加入四氯化碳充分振荡后静置,可观察到现象 ,能用四氯化碳从碘水中萃取碘的原因是 ,接着可用 方法将两层液体分开,操作时用到的化学仪器叫 。四氯化碳萃取碘后,如何分离出碘 。
为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:
(1)写出三种试剂的化学式:A ,B ,C 。
(2)加过量A的原因是
有关反应的化学方程式为:
(3)加过量B的原因是: 
有关反应的化学方程式为:
有一包白色粉末,可能由KCl、BaCO3、BaCl2、KNO3、NH4NO3和Na2SO4中的一种或几种组成。现进行下列实验:
(1)将此粉末溶于水中,得到无色透明溶液A及白色沉淀B,过滤。
(2)取沉淀物B,加稀HNO3后,沉淀物B不溶解。
(3)取少量溶液A,加入适量的NaOH溶液,加热,产生无色有刺激性气味并能使湿润的红色石蕊试纸变蓝色的气体。
(4)再取少量溶液A,滴入AgNO3溶液,充分反应后,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此推断,该白色粉末中,一定含有 ,肯定不含有 ,可能含有 。
NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是
洗涤沉淀的方法是 。
人们可根据物质的性质,采用适当的方式将混合物中的各物质分离。
(1)不溶性固体与水的混合物,如泥沙与水,可通过 方法分离。
(2)可溶性固体与水的混合物,如食盐与水,可通过 方法分离。
(3)两种可溶性固体,若它们的溶解度随温度变化不同,如氯化钠和硝酸钾,可通过
方法分离。
(4)两种互相溶解但沸点不同的液体,如乙醇与水,可通过 方法分离。
(5)两种互不相溶的液体,如汽油与水,可通过 方法分离。
(6)若混合物中各成分被某种固体吸附的难易不同,如墨水中的染料,可通过 方法分离。
某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案:
⑴操作①的目的是 。
⑵操作②是否可改为加硝酸钡溶液?为什么?
___________;____________________________________________________________。
⑶操作③的目的是 。
在盛有AgNO3、HBr、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如下表所列:
| |
① |
② |
③ |
④ |
⑤ |
| ① |
—— |
↑无色 |
↓白色 |
↓白色 |
无明显现象 |
| ② |
↑无色 |
—— |
无明显现象 |
↓淡黄色 |
无明显现象 |
| ③ |
↓白色 |
无明显现象 |
—— |
↓白色 |
无明显现象 |
| ④ |
↓白色 |
↓淡黄色 |
↓白色 |
—— |
↓黄色 |
| ⑤ |
无明显现象 |
无明显现象 |
无明显现象 |
↓黄色 |
—— |
| 结论 |
|
|
|
|
|
请在该表的“结论”中填写这些编号所代表的化学式
下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称 、
(2)分离以下混合物应该主要选用使用什么仪器?(填字母符号)
粗盐和泥沙: 食用油和酒精: 花生油和水:
(3)下列关于仪器的使用说法正确的是
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于向酒精灯中添加酒精
C.C仪器在放出液体时应打开上边的瓶塞
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和少量CCl4,震荡后静置,会观察到什么现象?
(5)若粗盐溶液中仅含有少量的CaCl2,某学生用Na2CO3使Ca2+离子转化为碳酸钙沉淀,确认Ca2+已沉淀完全的实验方法是 ;若要得到纯净的沉淀物,需要对其洗涤,写出洗涤沉淀的方法 。
.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的 CO32-、 SO42-、 和 Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,③ ,④ ,⑤冷却结晶。
(2)用托盘天平称量样品时,若某同学把样品放在右盘,砝码放在左盘,当天平平衡时读数为24.4g(一克以下用游码) ,则样品的实际质量为
(3)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有 生成,证明溶液中有碳酸根离子。
②在第二支试管里加入足量 后,再加入 ,可观察到有白色沉淀生成,证明溶液中有硫酸根离子。(写物质名称)
③在第三支试管里加适量的硝酸银,观察到有沉淀产生,由此证明溶液中一定含Cl-。你认为该结论是否严密? 为什么? 。
27.某学生进行蔗糖水解实验,并检验水解产物中是否含有葡萄糖。该生拟定如下操作:
| A.取一只试管制取Cu(OH)2沉淀备用; | B.再加入3ml~5mlH2SO4; | C.再加入3ml~5mlNaOH溶液; | D.加入NaOH溶液中和其中的硫酸;E.加入稀硫酸中和其中的氢氧化钠;F.把氢氧化铜沉淀加入溶液中;G.加热煮沸几分钟;H.加热至沸,观察之;I.取一支试管加入少量蔗糖溶液。 |
⑴从上述操作中选择必要的若干步,按实验正确顺序填入下列空格中:
A—( )—( )—( )—( )—( )—( )
⑵写出蔗糖水解的化学方程式 。
⑶写出用氢氧化铜检验葡萄糖的化学方程式 。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解法 | C.结晶法 |
| D.分液法 E.蒸馏法 F.过滤法 |
(1)________分离饱和食盐水与沙子的混合的。
(2)________从KNO3和NaCl的混合溶液中获得KNO3。
(3)________分离水和汽油的混合物。
(4)________分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物。
(5)________从碘的水溶液里提取碘。
(6)________从NaCl与NH4HCO3固体混合物中得到NaCl。
照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。(已知:4H++2 [Ag(S2O3)2]3-= Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)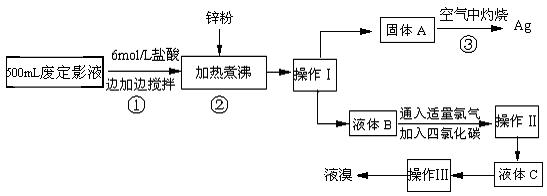
⑴操作Ⅲ的名称是 ▲ ;操作Ⅱ需要的主要玻璃仪器有 ▲ 。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 ▲。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 ▲ 。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 ▲ 。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 ▲ 。
粗食盐中除含有钙离子(CaCl2)、镁离子(MgCl2)、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为 。
何时停止加热 。
(2)如何运用最简方法检验溶液中有无SO42-离子,所用试剂 。如何检验SO42-离子是否除净简单操作为 。
(3)粗食盐中除去钙离子所用试剂为 。化学反应方程式
(4)粗食盐中除去镁离子所用试剂为 。化学反应方程式