某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案: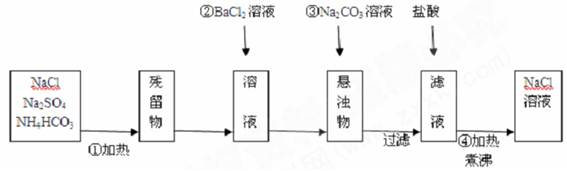
⑴操作①的目的是 。
⑵操作②是否可改为加硝酸钡溶液?为什么?
___________;____________________________________________________________。
⑶操作③的目的是 。
某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案:
⑴操作①的目的是 。
⑵操作②是否可改为加硝酸钡溶液?为什么?
___________;____________________________________________________________。
⑶操作③的目的是 。