按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是
| A.H2 | B.CO和H2 |
| C.NH3 | D.CH3CH2OH(气) |
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2-、CO32-,现取三份20mL该溶液进行如下实验:
⑴第一份加入足量盐酸,无任何气体产生
⑵第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
⑶第三份滴加0.10 mol∙L-l酸性KMnO4溶液,恰好完全反应,消耗其体积为VmL
⑷另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是
| A.原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B.由实验⑴可推断原混合溶液中是否含有SO42- |
| C.由实验⑵、⑶可判定原混合溶液中是否含有Fe3+ |
| D.由实验⑶可判定原混合溶液中存在NO2- |
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
由此可知原溶液中
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①用pH试纸检验,溶液的pH>7
②取少量原溶液,加入过量的BaCl2和盐酸的混合溶液,无白色沉淀产生
③另取少量原溶液,加入足量的氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分离
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入的AgNO3和HNO3的混合溶液有白色沉淀产生
则关于原溶液的判断中不正确的是( )
| A.肯定不存在的离子是Fe3+、NH4+、Cu2+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
能用来鉴别乙醇、乙酸溶液、葡萄糖溶液、苯四种无色液体的一种试剂是( )
| A.金属钠 | B.溴水 | C.新制的Cu(OH)2悬浊液 | D.氢氧化钠溶液 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是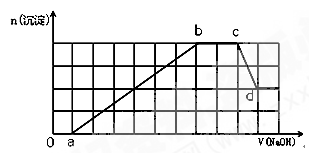
| A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.d点溶液中含有的溶质只有NaAlO2 |
下列说法正确的是
| A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- |
| B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- |
| C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ |
| D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
实验是研究化学的基础,下图中所示的实验方法、装置或操作均正确的是 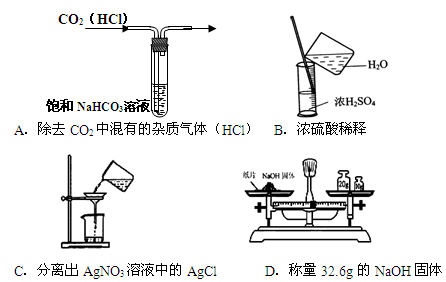
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据( )
| A.M(OH)2溶液的物质的量浓度 |
| B.与M CO3反应的盐酸的物质的量浓度 |
| C.MCO3的质量 |
| D.题给条件充足,不需要再补充数据 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
| C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在 |
| D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1 |
下列实验操作正确且能达到相应实验目的的是
| |
实验目的 |
实验操作 |
| A |
称取2.0gNaOH固体 |
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B |
制备Fe(OH)3胶体 |
向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C |
检验溶液中是否含有SO42- |
取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D |
萃取碘水中的碘 |
将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
某强酸性溶液中可能存在 中的若干种,现取适量溶液进行如下实验
中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有.
B.原溶液中一定没有
c.步骤③中反应的离子方程式为
D.气体A、B之间肯定不能发生反应
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为 ;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为 。
II.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为 。
(2)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
| A.①② | B.②⑨ | C.⑨④ | D.①④ |
(3)步骤⑤产生金属铜的化学方程式为 。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的l/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为 ,若此过程中共生成了8 gFe2O3,则转移的电子的物质的量为 。