某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:①取少量溶液加氢氧化钠溶液过程中无沉淀生成;②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:
| A.该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤,剩余沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+一定存在,且c(K+)≥0.2mol ·L―1 |
| B.100 mL溶液中含CO32― 0.01mol |
| C.K+不一定存在 |
| D.Cl― 一定存在 |
按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是
| A.H2 | B.CO和H2 |
| C.NH3 | D.CH3CH2OH(气) |
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
在一定条件下,萘可与浓硝酸、浓硫酸两种混酸反应生成二硝基化合物,它是1,5-二硝基萘和1,8-二硝基萘的混合物。
后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这二种异构体分离。在上述硝化产物中加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8 -二硝基萘,应采用的方法是
| A.对所得的滤液蒸发浓缩冷却结晶 | B.向滤液中缓缓加入水后过滤 |
| C.将滤液缓缓加入水中后过滤 | D.向滤液中缓缓加入Na2CO3溶液后过滤 |
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
| A.原溶液中一定含有Br-、SO42- |
| B.原溶液一定含有Na+,不含Ba2+ |
| C.实验①与上述离子的检验无关,可以省略 |
| D.若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
下列除去杂质的方法中正确的是
①除去乙烷中少量的乙烯:通入适量H2 ,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去硝基苯中少量的NO2:滴入适量的NaOH溶液后,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去蛋白质中少量离子:用半透膜,渗析
| A.①②④ | B.②③④ | C.②④⑤ | D.③④⑤ |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液200 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl-) ≥ 0.2mol/L |
| C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
某白色固体可能由①NH4Cl、②AlCl3、③KCl、④AgNO3、⑤NaOH中的一种或几种组成,此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀产生.则对原固体的判断不正确的是
| A.肯定存在① |
| B.至少存在②和⑤ |
| C.无法确定是否有③ |
| D.至少存在①、④、⑤ |
下列说法正确的是
| A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- |
| B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- |
| C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ |
| D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
实验是研究化学的基础,下图中所示的实验方法、装置或操作均正确的是 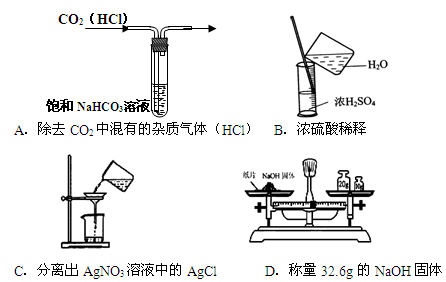
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据( )
| A.M(OH)2溶液的物质的量浓度 |
| B.与M CO3反应的盐酸的物质的量浓度 |
| C.MCO3的质量 |
| D.题给条件充足,不需要再补充数据 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
| C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在 |
| D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1 |
下列实验操作正确且能达到相应实验目的的是
| |
实验目的 |
实验操作 |
| A |
称取2.0gNaOH固体 |
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B |
制备Fe(OH)3胶体 |
向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C |
检验溶液中是否含有SO42- |
取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D |
萃取碘水中的碘 |
将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |