过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是 ( )
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ | D.③⑤②①④ |
强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、H+、Mg2+、OH—、Cl—、HCO3—、SO42—。(每种溶液中溶质电离出的离子各不相同)。已知:①甲溶液分别与其它三种溶液混合,均产生白色沉淀;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是( )
| A.四种物质中一定有共价化合物 |
| B.四种物质中一定有Ba(OH)2 |
| C.丙溶液中含有NH4+ |
| D.丁溶液中含有HCO3— |
下图为海水综合利用的工业流程图,判断下列说法正确的是
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
| A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L |
| B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ |
| C.n(NH4+):n(Al3+):n(SO42-)=3:1:10 |
| D.原溶液一定存在Cl- |
(改编)下列除杂方法正确的是
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
| A.①②③ | B.②④⑤ | C.③④⑤ | D.②③④ |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤,剩余沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+一定存在,且c(K+)≥0.2mol ·L―1 |
| B.100 mL溶液中含CO32― 0.01mol |
| C.K+不一定存在 |
| D.Cl― 一定存在 |
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
| A.原溶液中一定含有Br-、SO42- |
| B.原溶液一定含有Na+,不含Ba2+ |
| C.实验①与上述离子的检验无关,可以省略 |
| D.若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液200 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl-) ≥ 0.2mol/L |
| C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
某白色固体可能由①NH4Cl、②AlCl3、③KCl、④AgNO3、⑤NaOH中的一种或几种组成,此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀产生.则对原固体的判断不正确的是
| A.肯定存在① |
| B.至少存在②和⑤ |
| C.无法确定是否有③ |
| D.至少存在①、④、⑤ |
下列说法正确的是
| A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- |
| B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- |
| C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ |
| D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
实验是研究化学的基础,下图中所示的实验方法、装置或操作均正确的是 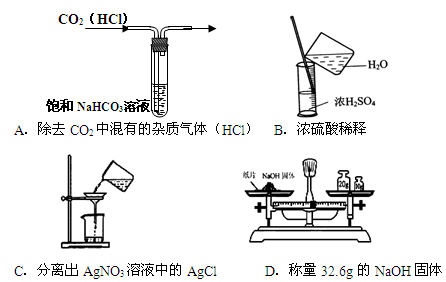
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据( )
| A.M(OH)2溶液的物质的量浓度 |
| B.与M CO3反应的盐酸的物质的量浓度 |
| C.MCO3的质量 |
| D.题给条件充足,不需要再补充数据 |