现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验:
现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验:
(1)将一定量的固体溶于水,得到无色澄清的溶液;
(2)将实验(1)中的溶液分成三份:在第一份溶液中加入足量的氢氧化钠溶液并加热,生成一种能使湿润红色石蕊试纸变蓝色的气体;在第二份溶液中滴入足量的稀盐酸,生成一种能使澄清石灰水变浑浊的气体;在第三份溶液中加入新制的氯水后,溶液变成深黄色,加入四氯化碳后振荡、静置,下层液体呈紫 红色。试
红色。试 回答下列问题:
回答下列问题:
(1)原固体混合物中一定存在的物质是 ,一定不存在的物质是 。
(2)实验(2)中第一份溶液与氢氧化钠溶液共热时发生的反应方程式
。
欲从溶有苯酚的乙醇中回收苯酚,有下列操作:①蒸馏 ②过滤 ③静置分液
④加入足量的金属钠 ⑤通入过量的二氧化碳 ⑥加入足量的NaOH溶液
⑦加入足量的FeCl3溶液 ⑧加入硫酸与NaBr共热,合理的步骤是
| A.④⑤③ | B.⑥①⑤③ | C.⑥①⑤② | D.⑧②⑤③ |
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研 究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
已知第② 步反应的离子方程式为:5Mn2+ + 2ClO3- + 4H2O → 5MnO2↓ + Cl2↑
步反应的离子方程式为:5Mn2+ + 2ClO3- + 4H2O → 5MnO2↓ + Cl2↑ + 8H+
+ 8H+
根据题意完成第41~46题:
41.第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性 物质。
物质。
42.写出第③步反应的化学方程式  ;
;
43.实验室里完成第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、玻璃棒。
44.该流程中可以循环使用的物质是 。
45.若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224 L CO2(标准状况下),则在第①步反应中至少需要 mol H2SO4。
46.已知2H2O2(l) → 2H2O(l) +O2(g),反应过程的能量变化如图所示。
 |
①该反应为 反应(填“吸热”或“放热”)。
②请用虚线在图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图。
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、NO3-、SO42-、Cl-、HCO3-、Cu2+,取该溶液实验如下:
①取少量该溶液,加几滴石蕊试液, 溶液变红色
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③取少量该溶液 ,加BaCl2溶液, 有白色沉淀生成
,加BaCl2溶液, 有白色沉淀生成
④取③中上层清液,加AgNO3溶
 液, 有白色沉淀生成,且不溶于HNO3
液, 有白色沉淀生成,且不溶于HNO3
⑤取少量该溶液,加NaOH溶液, 有白色沉淀生成,当NaOH过量时沉淀部分溶解
根据上述实验现象判断:
(1)溶液中肯定存在的离子是 。
(2)溶液中肯定不存在的离子是 。
(3)为进一步确定可能存在的离子,应该补充的实验是 。
(8分)(2011·苏州模拟)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子。向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为________(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为
________________________________________________________________________、______________________________________________________________________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为________________________________________________________。
某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_______ ______,
肯定不存在的离子是_______ _________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
① ②
③ ④
⑤
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7。
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后
CCl4层呈橙色,用分液漏斗分液。
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。
则关于原溶液的判断中不正确的是( )
| A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
下列除去杂质(括号内物质为少量杂质)的方法中,正确的是
| A.乙烷(乙烯):光照条件下通入Cl2,气液分离 |
| B.乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液 |
| C.CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶 |
| D.乙醇(乙酸):加足量浓硫酸,蒸馏 |
下列物质分离方法不正确的是
| A.分离铁屑与水的混合物——倾析法 |
| B.分离铜离子和铁离子的混合物——纸层析法 |
| C.分离溴和水的混合物——分液法 |
| D.分离硝酸钾和氯化钠的混合物——结晶法 |
某K2CO3样品中含有Na2CO3、KNO3和Ba(OH)2三种杂质中的一种或两种。现将13.8克样品加入入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀。对样品所含杂质的正确判断是( )
| A.一定含有KNO3 | B.一定含有KNO3,可能含有Na2CO3 |
| C.一定不含Ba(OH)2,可能含有KNO3 | D.一定不含Na2CO3和Ba(OH)2 |
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是
| 选项 |
待提纯的物质 |
选用的试剂 |
操作的方法 |
| A |
CaO(CaCO3) |
水 |
溶解、过滤、结晶 |
| B |
Cu(CuO) |
稀盐酸 |
溶解、过滤、洗涤、干燥 |
| C |
CuSO4(H2SO4) |
氢氧化钠溶液 |
过滤 |
| D |
CO(H2) |
氧气 |
点燃 |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| |
被提纯的物质 |
除杂试剂 |
分离方法 |
| A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取 |
| B |
氯化铵溶液(AlCl3) |
氢氧化钠溶液 |
过滤 |
| C |
二氧化碳(C0) |
氧化铜粉末 |
通过灼热的CuO粉末 |
| D |
乙醇(苯酚) |
氢氧化钠溶液 |
分液 |
化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
| A.定性检验SO42—,将BaCl2溶液用HNO3酸化 |
| B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化 |
| C.配制FeCl3溶液时通常加少量HNO3酸化,减小其水解程度 |
| D.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 |
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+离子,不经处理排放危害极大。某工厂技术人员设计了创新方案,使有害离子的浓度降低到排放标准,同时得到了纯度较高的镍粉。
废液经分析组成如下: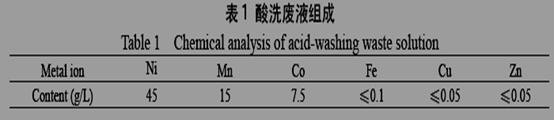
在强酸性的废液中加入NaOH调节pH到2,在搅拌下加入饱和Na2CO3溶液和NaClO除去Mn2+、Co2+,并控制pH不超过3.5(Na2CO3需缓慢加入,防止产生大量CO2而冒槽),过滤后电解含Ni2+的过滤液,以镍铬钛不锈钢片为阴极,以铅片为阳极,电解后在阴极得到镍粉。回答下列问题
⑴ 调节强酸性废液至pH=2,可否直接用饱和Na2CO3溶液?分析你的原因
⑵ 写出除去废液中Mn2+、Co2+的反应方程式
⑶ 搅拌过程中Ni不被沉淀下来,实际操作中是如何实现?
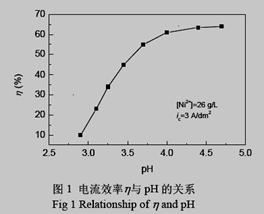
⑷ 电解过程中电流效率与pH的关系如下图,试分析如下图所示变化的原因.并选择电解的最佳pH值