(15分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
_______________________________________________________________
(4)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
| D |
碱性的废水 |
用CO2来中和 |
化学法 |
[2012·江苏卷] 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下:
(2)①铜帽溶解时加入H2O2的目的是______ _____________________(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法____ ___。
(3)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O32-+I2===2I-+S4O62-
①滴定选用的指示剂为________,滴定终点观察到的现象____________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“ 不变”)。
已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①____________________________________________________________;
②__________________________________________________________________;
③过滤;
④___________________________________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
[2012·泉州第二质检]有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。为确定其成分,进行如下实验:①取部分溶液,逐滴滴入NaOH溶液至过量,只观察到白色沉淀先增多后又部分溶解,无其它明显现象;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是
| A.肯定有Al3+、Mg2+、Cl-,可能有K+ |
| B.肯定有Al3+、Mg2+、Cl-,可能有NH4+ |
| C.肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- |
| D.肯定有K+、Al3+、MnO4-,可能有HCO3- |
[2012·全国卷]氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。
回答下列问题:
(1)起始滤液的pH__7(填“大于”、“小于”或“等于”),其原因是____________;
(2)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为___________ ______;
(3)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是____________ ________;
(4)试剂Ⅲ的名称是________,③中发生反应的离子方程式为_________ ____;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为_________________________________(列式并计算结果)。
.[2012·浙江卷] 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断正确的是( )
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.K+、AlO2-和SiO32-一定存在于溶液X中 |
| D.CO32-和SO42-一定不存在于溶液X中 |
[2012·临沂一模]某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向(2)所得的水溶液中加入 Ba(NO3)2和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤
C.不能确定的离子是① D.不能确定的离子是③⑤
(15分) 现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1)写出化学式: B______ C______ D E
(2)E溶液中滴加过量氨水的离子方程式______________________________ ;
(3)请简述A中的阳离子的检验方法及实验现象:________________________________
(4) 在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为
mol
(8分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有 离子;
一定不含有 离子;还有_________________离子不能确定是否存在,要检验这些离子的实验方法是 ,操作是______________________________________________。
有一已磨成粉末的混合物试样,是由下列六种物质中的若干种等量组成﹕
(A) NaCl (B) KCl (C) CaCl2 (D) CuSO4( 无水) (E) Na2SO4 (F) Na2CO3
为了要确定该粉末试样的成分,某研究性学习小组先查了资料后,研拟了一个检验粉末试样的流程图,并在老师的指导下在化学实验室中进行实验。以下是该小组实验报告的一部份:
实验一:用烧杯取粉末试样约2g,加蒸馏水约100mL,搅拌后形成无色的透明溶液X。
实验二:在溶液X中加了盐酸,观察到在溶液中陆续产生气泡,至溶液不再冒气泡,溶液仍为无色透明(贴上卷标Y)。
实验三:在无色透明的溶液Y中,滴加BaCl2溶液,即见白色沉淀。
实验四:继续滴加BaCl2溶液,至白色沉淀不再产生后,过滤分离出白色沉淀,得到透明的无色滤液Z。
实验五:在滤液Z中,滴入AgNO3溶液,则见白色沉淀,加入稀硝酸,沉淀不溶解。
(1)根据上述实验报告,原粉末中一定没有哪两种物质 ﹖(从(A) -(F)中选两项,填字母)
(2)原粉末中,一定含有哪两种物质 ﹖(从(A) -(F)中选两项)
(3)若只需回答上述(1)(2)的问题,你认为该小组同学不需要做哪两个实
验
(A) 实验一 (B) 实验二 (C) 实验三 (D) 实验四 (E) 实验五
为验证木炭可被浓硫酸氧化成二氧化碳,选用下图中的仪器(含所盛物质)组装成套实验装置,回答下列问题。(KMnO4能吸收SO2) 
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该
是 接 , 接 , 接 。
(2)试管B,C中各有什么现象,才能表示已检验出二氧化碳?
B中 ,C中 。
(3)试管D中能否用饱和NaHCO3溶液代替酸性KMnO4溶液?
说明理由:
(4)试管E的作用是
(5)写出A中反应的化学方程式:
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2-、CO32-,现取三份20mL该溶液进行如下实验:
⑴第一份加入足量盐酸,无任何气体产生
⑵第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
⑶第三份滴加0.10 mol∙L-l酸性KMnO4溶液,恰好完全反应,消耗其体积为VmL
⑷另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是
| A.原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B.由实验⑴可推断原混合溶液中是否含有SO42- |
| C.由实验⑵、⑶可判定原混合溶液中是否含有Fe3+ |
| D.由实验⑶可判定原混合溶液中存在NO2- |
某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是( )
| A.该溶液中可能含有Na+ |
| B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3- |
| C.该溶液中一定不含NO3- |
| D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/L |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是__________________,不能确定是否存在的离子是__________。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号________,浓度_________________________;
离子符号________,浓度_________________________;
离子符号________,浓度_________________________。
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是_______________。
某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
Ⅰ:
(1) 废Cu粉中一定含有的杂质是 。
(2) 分别写出过程①、②发生反应的离子方程式:
① ;
② 。
Ⅱ: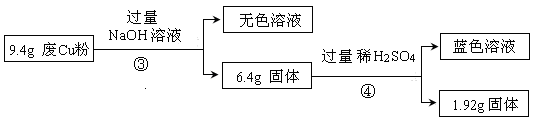
(3)综合过程Ⅰ、II,计算工业废Cu粉中各成分的质量之比是 (不必化简)。
Ⅲ:已知25℃时:
| 电解质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积(Ksp) |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 开始沉淀时的pH |
5.4 |
6.5 |
3.5 |
| 完全沉淀时的pH |
6.4 |
9.6 |
4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与Ⅲ方案相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2(填“>”,“<”或“=”) 