(1)电动汽车的动力系统由“10kW电机+144V镍氢电池”组成。
镍氢电池的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2="==" NiO(OH)+1/2H2。其放电时正极电极反应式为_________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下: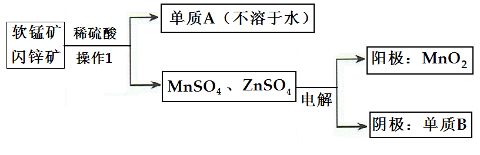
①单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:________________
某化学学习小组欲设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(预计H2的体积6mL左右)同时检验氯气的氧化性。现有以下的仪器可供选择: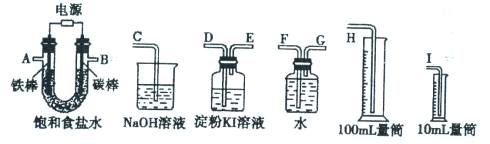
(1)若要完成以上的实验,将所给仪器连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接 、 接 ,B 接 、 接 。
( 2)能说明氯气具有氧化性的实验现象是 。
(3)已知氯气溶于水中有如下平衡:Cl2+H2O HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。
HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。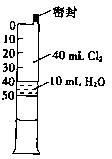
①若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是 。
②用化学平衡的观点解释①的现象:
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为__ __。
某澄清溶液中,可能含有NH4+、Mg2+、Na+、Fe2+、Ag+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
(1)用pH试纸检验时,试纸呈深红色。
(2)取溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫色。
(3)向(2)所得水溶液中加入AgNO3溶液,有白色沉淀生成。
(4)另取原溶液,调节pH使其呈中性后,滴加NaOH溶液,开始得白色沉淀;接着加入过量NaOH溶液,过滤后给滤液加热,有刺激性气味的气体产生。
(一)由此判断原溶液中一定有大量的 离子。
(二)判断有无I-所应用的反应的离子方程式是
(三)判断有无Mg2+所应用的反应的离子方程式是
(四)在不能确定的离子中,如何检验其中的阳离子?写出试验名称及判断依据的现象。
根据下图回答问题:
(1)写出浓H2SO4和木炭粉在加热条件下反应的化学方程式 。
(2)若用图中的装置检验上述反应的全部产物,完成下列各题:
A中加入的试剂是 ,作用是
B中加入的试剂是 ,作用是
C中加入的试剂是 ,作用是
D中加入的试剂是 ,作用是
(3)实验时,C中应观察到的现象是:
有四瓶编号为a、b、c、d的浓溶液,分别含有下列离子NH4+、Ba2+、Al3+、H+、OH-、Cl-、HCO3-、SO42-中的两种。为鉴别各溶液的成分,取3份a溶液,向其中分别逐滴滴入b、c、d三种溶液,b和c立即出现沉淀,c同时产生气体,继续逐滴滴入,一段时间后d也出现沉淀。下列结论正确的是
| A.a溶液含有SO42- | B.b溶液含有Ba2+ |
| C.c溶液含有NH4+ | D.d溶液含有Cl- |
(本小题满分14分)某研究性学习小组欲验证红热的炭与浓硫酸发生反应所生成的各种产物,按气体的流动方向设计了如下实验流程:
(1)①中反应的化学方程式为 ;
(2)②处的现象是: 。
(3)品红溶液使用了两次,第一次使用时的作用是
第二次使用时的作用是________________ _。
(4)二氧化硫也能使溴水褪色,表现了二氧化硫的 性。(“还原”、“漂白”)
反应的化学方程式为: 。
(5)根据 现象,可证明产物中一定有CO2气体
某无色溶液中含有:①Na+、②Ba2+、③C1—、④Br—、⑤SO32-、⑥SO42-、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| ① |
用pH试纸检验 |
溶液的pH大于7 |
| ② |
向溶液中滴加氯水,再加入CC14振荡,静置 |
CC14层呈橙红色 |
| ③ |
取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| ④ |
将③过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
根据上述实验现象,判断以下结论中正确的是 ( )
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤⑦
C.可能含有的离子是①②⑥ D.不能确定的离子是①③⑥
除去下列物质中所含少量杂质(括号内为杂质),所选试剂和分离方法能达到实验目的是 ( )
| |
混合物 |
试剂 |
分离方法 |
| A |
乙烷(乙烯) |
H2、催化剂 |
-------- |
| B |
甲苯(苯酚) |
溴水 |
过滤 |
| C |
溴乙烷(溴) |
Na2SO3 |
分液 |
| D |
乙酸乙酯(乙酸) |
NaOH溶液 |
分液 |
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1.4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
⑴步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是________、________。
⑵步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式____________________________。
②调整pH 的范围应该在____________之间。
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,_____________,水浴加热烘干。采用水浴加热的原因是____ 。
⑷该同学用CuSO4溶液进行如下探究实验:取A、B两支试管,分别加入 2 mL 5%H2O2溶液,再向H2O2溶液中分别滴入0.1 mol·L-1FeCl3和CuSO4溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确________(填正确或错误),请说明原因 。
关于物质的检验,下列判断正确的是 ( )
A.在溶液中加入盐酸酸化,无现象;再加入B aCl2溶液,如果生成白色沉淀,则原溶液中一定有SO42— aCl2溶液,如果生成白色沉淀,则原溶液中一定有SO42— |
| B.在溶液中加入AgNO3溶液,生成不溶于硝酸的沉淀,则原溶液中一定有Cl— |
C.在某盐溶液中加入浓NaOH溶液 ,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液 ,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液 |
| D.为检验钠盐中是否混有钾盐,直接观察焰色为黄色,则不含钾盐 |
某溶液中可能含有下列离子:Na+、Fe2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等,将该溶液分成4份,进行如下实验:
第一份滴加适量的淀粉KI溶液,呈蓝色;
第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
第四份加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。
下列说法正确的是
| A.该溶液中肯定存在的离子有NH4+、SO42-、NO2- |
| B.该溶液中肯定存在的离子有NH4+、Cl-、NO3- |
| C.该溶液中肯定不存在Fe2+、SO32-、NO2- |
| D.该溶液中可能存在Na+、Fe2+、Cl- |
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是:
+ ClO3—+ = MnO2↓+ Cl2↑+ 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0、224LCO2(标准状况下),则在第①步反应中至少需要 mol H2SO4。
(已知摩尔质量:MnO2 -87g/mol; MnO-71g/mol; MnCO3-115 g/mol)
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子是___________,若要验证该离子是否存在,最可靠的化学方法是_______________________
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A________________________ 。
②_________ 。
海水是巨大的资源宝库,从海水中提取食盐和溴过程如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的新产品有H2、____、____或H2、_____。
(2)步骤Ⅱ中用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______。
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件_______。
②C中液体产物颜色为_______,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_______。
③用离子方程式解释NaOH浓溶液的作用 。