按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物: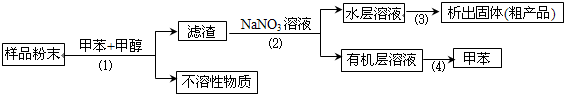
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
下列实验操作中正确的是
| A.蒸馏液体时,冷水应从冷凝管的上端进入 |
| B.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
| C.提取碘水中的碘:加入适量乙醇,振荡、静置、分液 |
| D.做焰色反应前应先将铂丝在稀硫酸中洗干净再蘸取待测液进行实验 |
下列说法错误的是( )
| A.提纯液体混合物常用重结晶法 |
| B.蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 |
| C.萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 |
| D.常用质谱法进行有机物相对分子质量的测定 |
实验室制取氧气的反应为2KClO3 2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体) ( )
2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体) ( )
| A.溶解、过滤、蒸发、洗涤 | B.溶解、过滤、洗涤、干燥 |
| C.溶解、蒸发、洗涤、过滤 | D.溶解、洗涤、过滤、加热 |
某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液.
(2)滴定
①用____________量取10.00 mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010 mol·L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到______________________时停止滴定.
(3)数据处理
| 实验次 序编号 |
盐酸溶液体积 V/mL |
氢氧化钠溶液体积 V/mL |
| 1 |
19.90 |
10.00 |
| 2 |
20.10 |
10.00 |
| 3 |
22.00 |
10.00 |
| 4 |
20.00 |
10.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为________________,烧碱的纯度为________(保留两位小数)。
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是(多选)( )
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100 mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
现有一瓶A和B的混合物,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm—3 |
溶解性 |
| A |
—11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是
A.蒸馏 B.蒸发 C.分液 D.过滤
为了提纯下列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
| 选项 |
被提纯的物质 |
除杂试剂 |
分离方法 |
| A |
溴苯(溴) |
水 |
分液 |
| B |
乙酸乙酯(乙酸) |
NaOH溶液 |
分液 |
| C |
苯(苯酚) |
NaOH溶液 |
分液 |
| D |
甲烷(乙烯) |
KMnO4酸性溶液 |
洗气 |
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
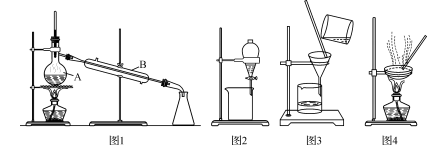
(1)装置图l中A的名称是 ,B的名称是 。
A中一般要加入碎瓷片,其作用是 。装置图4中盛溶液的仪器名称是 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

i灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需仪器,将标号字母填写在空白处);
A 烧杯 B 坩埚 C 表面皿 D 泥三角 E 酒精灯
ii步骤③的实验选择上述装置图 (填图的序号);
iii步骤⑤的实验操作名称是_____________;
iV步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是 _,选择上述装置图 (填图的序号)。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 .
(2)写出实验③中的离子方程式: .
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象) .
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
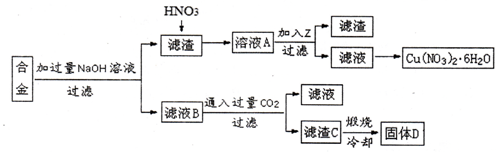
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
海水提镁的工业流程如下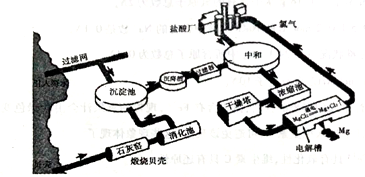
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2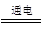 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
下列各组物质中,能用高锰酸钾酸性溶液鉴别的是
| A.乙烯、乙炔 | B.1-己烯、甲苯 | C.苯、正己烷 | D.丙烷 丙炔 |