甘肃省张掖、嘉峪关、山丹部分高中高三上学期期中联考化学试卷
化学与生产、生活密切相关。下列叙述中,不正确的是
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH < 5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3
| A.②③⑦ | B.②⑥⑦⑧ | C.②③⑦⑧ | D.①②③⑥⑧ |
下列说法不正确的是
① CO2分子的比例模型示意图:
②-OH与 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
③HCN分子的结构式:H-C≡N;
④NaHCO3在水中的电离方程式:NaHCO3 Na++H++CO32-;
Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥铝既能与盐酸反应又能与NaOH溶液反应,故铝是两性元素;
⑦风化、干馏、裂化都是化学变化
| A.①②⑤ | B.③④⑦ | C.①④⑥ | D.④⑤⑥ |
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
| A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸 |
| C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质 |
| D.NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物 |
若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.16g CH4与18 g NH4+ 所含质子数相等 |
| B.0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA |
| C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |
| D.7.8 g Na2O2中含有的离子总数目为0.3NA |
下列溶液中的离子一定能大量共存的是
| A.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- |
| C.能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- |
| D.含大量Fe3+的溶液中:NH4+、Na+、C1-、SCN- |
海水开发利用的部分过程如图所示。下列说法错误的是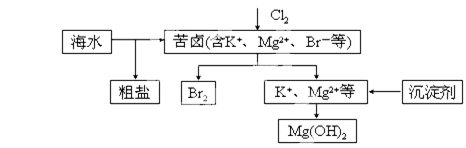
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
下列说法正确的是
| A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 |
| C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- |
| D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
下列叙述I和II均正确并且有因果关系的是
| |
叙述I |
叙述II |
| A |
NaHCO3能与碱反应 |
食品工业用NaHCO3作焙制糕点的膨松剂 |
| B |
Al既可和酸反应又可和强碱反应 |
Al可制成铝箔包装物品 |
| C |
K2FeO4能与水作用生成Fe(OH)3胶体和O2 |
可K2FeO4用于净化自来水并杀菌消毒 |
| D |
HClO具有弱酸性 |
HClO可作漂白剂 |
下列有关试剂的保存方法正确的是
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中
| A.①③⑤ | B.②③⑤ | C.②④⑤ | D.①③④ |
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe |
下表各组物质中,物质之间不可能实现如图 所示转化的是
所示转化的是
| 选项 |
X |
Y |
Z |
M |
| A |
Fe(s) |
FeCl2 |
FeCl3 |
Cl2 |
| B |
NaOH(aq) |
Na2CO3 |
NaHCO3 |
CO2 |
| C |
NH3(g) |
NO |
NO2 |
O2 |
| D |
S(s) |
SO2 |
SO3 |
O2 |
研究发现CuSO4和FeS2在一定条件下可发生如下反应: 14CuSO4+5FeS2+12H2O =7Cu2S +5FeSO4 +12H2SO4;下列说法正确的是
| A.FeS2中的硫元素全部被氧化 |
| B.5 mol FeS2发生反应,有10 mol电子转移 |
| C.产物中SO42-有一部分是氧化产物 |
| D.FeS2只用作还原剂 |
下列关于物质或离子检验的叙述正确的是
| A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
| B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 |
| C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
下列离子方程式正确的是
| A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O |
| B.CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3-H2O=Cu(OH)2↓+2NH4+ |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合: Al3++ 2SO42-+ 2Ba2++ 4OH- = 2BaSO4↓ + AlO2-↓ +2 H2O |
| D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
下述实验操作与预期实验目的或所得实验结论不一致的是
| 编号 |
实验操作 |
实验目的或结论 |
| A |
将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 |
证明SO2有漂白性 |
| B |
向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 |
探究增大反应物浓度时平衡移动的方向 |
| C |
将装有NO2和N2O4气体的连通球,一个置于冰水中,一个置于热水中,观察颜色变化 |
探究温度对化学平衡的影响 |
| D |
将CO2通入Na2SiO3水溶液观察是否有沉淀产生 |
探究碳和硅两元素非金属性强弱 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
| A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
向足量的下列物质分别与一定量氯水反应后所得的溶液中滴入KSCN溶液,不一定显血红色的是
| A.氧化铁 | B.铜铁合金 | C.Fe(OH)3 | D.FeCl2 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法不正确的是
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得混合气体X一定有O2 |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1 |
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
| A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ |
| B.溶液中一定不含CO32-和NO3-,一定含有SO42- |
| C.溶液中c(NH4+)=0.3 mol/L |
| D.c(H+)∶c (Al3+)∶c(Mg2+)=1∶1∶1 |
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
| |
物质及其杂质 |
检验 |
除杂 |
| A |
Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B |
NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |
| C |
CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D |
NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1 g·cm-3与密度为1.2 g·cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g·cm-3与1.2 g·cm-3之间,Na-K合金的熔点应介于Na和K熔点之间
| A.①② | B.①④ | C.①②③④ | D.①②④ |
镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为
| A.26g | B.29.1g | C.29.5g | D.24g |
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| B.加入NaOH溶液的体积是50mL |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol |
| D.得到的金属氢氧化物的沉淀为3.12克 |
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO·Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是 。
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,产生H2的离子方程式是 。
(3)工业上以铝土矿(Al2O3·H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al。
铝土矿粉粹的目的是 ,试剂A的化学式是 ,电解熔融Al2O3时,加入冰晶石,其作用是 。
(4)明矾化学式为KAl(SO4)2·12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是 。
(5)美国普度大学研究开发出一种利用铝镓(化学式:AlGa)合金制取氢气的新工艺(如下图所示)。
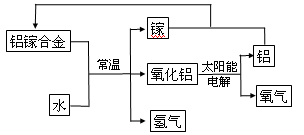
i.写出常温下铝镓合金产生氢气的化学方程式 。
ii.下列有关该工艺的说法正确的是 。
| A.该过程中,能量的转化形式只有两种 |
| B.铝镓合金可以循环使用 |
| C.铝镓合金的熔点比金属铝低 |
| D.该工艺可利用太阳能分解水 |
I:A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):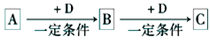
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少量D,其理由是(用必要的文字和离子方程式表示)_______________________.
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_______________________。
化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加入溶液的体积关系如下图所示:
则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II某一离子反应体系有反应物和产物共以下六种:MnO4—、H+、O2、H2O、H2O2、Mn2+。已知该反应中的H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________。
(2)该反应中.发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___________
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:[SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
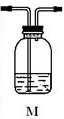
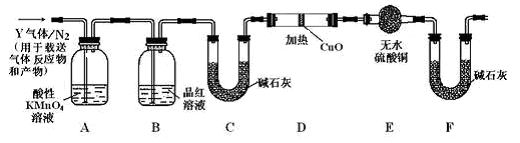
(3)装置B中试剂的作用是___________________
(4)认为气体Y中还含有Q的理由是________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法?做出判断并说明理由__________
以食盐为原料进行生产并综合利用的某些过程如下图所示。
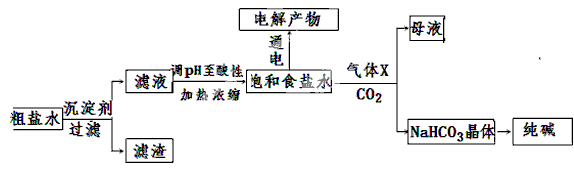
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
| A.NaHCO3属于盐类,纯碱属于碱 |
| B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同 |
| C.常温下在水中的溶解度,NaHCO3大于纯碱 |
| D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2 |


 粤公网安备 44130202000953号
粤公网安备 44130202000953号