某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
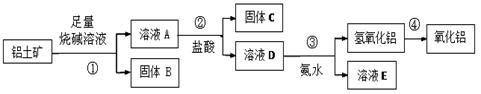
(1)固体B的主要用途有(写出1条即可) 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是: ; 。
(3)第③步中,生成氢氧化铝的离子方程式是 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
下列各组混合物中,能用分液漏斗进行分离的是
| A.酒精和水 | B.碘和四氯化碳 | C.水和四氯化碳 | D.汽油和植物油 |
丙酮是常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮的方法是
| A.蒸发 | B.分液 | C.过滤 | D.蒸馏 |
下列有关离子检验的操作和实验结论都正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 |
该溶液中一定含有SO42- |
| B |
浓硫酸滴入蔗糖中,搅拌得黑色蓬松的固体并有刺激性气味 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
在酒精灯上加热铝箔,铝箔熔化,但不滴落,好像有一层膜兜着 |
铝易被氧化;铝的熔点比氧化铝低 |
| D |
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 |
该溶液中一定含有CO32- |
下列各组混合物中,能用分液漏斗进行分离的是( )
| A.酒精和水 | B.碘和四氯化碳 | C.水和四氯化碳 | D.汽油和植物油 |
对于溶液中某些离子的检验及结论一定正确的是( )
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
现有三组溶液:①汽油和氯化钠溶液 ②49%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A.分液、蒸馏、萃取 | B.萃取、蒸发、分液 |
| C.分液、萃取、蒸馏 | D.蒸馏、萃取、分液 |
下列实验操作中错误的是( )
| A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.可用酒精萃取碘水中的碘 |
| D.除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
为了除去粗盐中的 Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
海水的综合利用可以制备金属镁,其流程如下图所示:
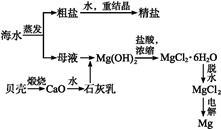
(1)完成下列方程式:
煅烧贝壳(化学方程式): ;
Mg(OH)2加盐酸(离子方程式):
(2)电解熔融MgCl2的反应化学方程式是 。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发3个步骤的操作中都要用到玻璃棒,分别说明在这3种情况下使用玻璃棒的目的。
溶解时: 。
过滤时: 。
蒸发时: 。
(4)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl和HCl,写出相应反应的化学方程式: 。
下列分离或提纯物质的方法正确的是( )
| A.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C.用渗析的方法精制Fe(OH)3胶体 |
| D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
检验酒精中是否含有水,可选用的试剂是( )
| A.金属钠 | B.浓硫酸 | C.无水硫酸铜 | D.胆矾 |