已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图:
(1)Cu元素基态原子的外围电子排布式为_________。
(2)请在图中画出A中的配位键(用→表示)
(3)A中碳原子的轨道杂化类型为_________
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
则该化合物的化学式是_________。
下列说法中错误的是( )
| A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 |
| B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 |
| C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同 |
| D.短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b |
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.铈(Ce)元素在自然界中主要以单质形式存在 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+ |
D.四种稳定的核素 、 、 、 、 、 、 ,它们互称为同位素 ,它们互称为同位素 |
下列说法正确的是
①具有规则几何外形的固体一定是晶体
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
| A.①②⑤⑥ | B.③④⑥⑦ | C.②④⑦⑧ | D.③④⑤⑧ |
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
| |
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
| |
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有 个,π键有 个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 ,属于 分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。

在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
X、Y、Z 、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:
、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:
⑴ L的元素符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ,B—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,B—空气燃料电池放电时:负极的电极反应式是: 。
⑶硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的特征构型的电子排布式为 ,其最高价氧化物对应的水化物化学式为 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaOH 溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式: ;
(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。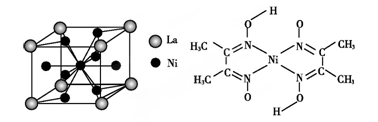
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。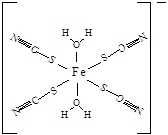
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。
铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
| A.离子键 | B.金属键 | C.配位键 | D.非极性键 E.极性键 |
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(6)铜的某氯化物的晶胞结构如右图所示,该化合物的化学式为 。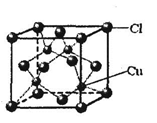
常见元素A、B、C、D,其原子结构的相关信息如下表:
| 元素 |
相关信息 |
| A |
A原子的核外电子总数等于其基态电子层数 |
| B |
B原子的最外层电子数是次外层电子数的2倍 |
| C |
C的基态原子L电子层中有3个未成对电子 |
| D |
D的外围电子层排布为(n+1)d3n(n+2)sn |
请回答下列问题:
(1)A的原子结构示意图是_______;D元素位于周期表第______周期 ______族。
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足______(填字母序号),分子中所有的原子就有可能在同一个平面内。
A.sp3或sp2杂化轨道
B.sp3或sp杂化轨道
C.sp或sp2杂化轨道
(3)如图,在B晶体的一个晶胞中含有______个B原子。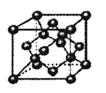
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3。
①CA3分子是______(填“极性”或“非极性”)分子。
②写出制备C2A4的总反应方程式____________
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):______________________________
不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬)、Ni(镍)、Mo(钼),少量的Si(硅)、C(碳),微量的S(硫)、P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______。
(4)镍元素能形成多种配合物,配离子[Ni(CN)4]2—中不含有的是____(填选项编号)。
| A.离子键 | B.配位键 | C.σ键 | D.π键E.氢键 |
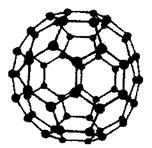
(5)碳元素有多种单质,其中C60分子有独特的球形结构:C60分子中原子轨道杂化类型是_______。
(6)碳的另一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加人镁原子层,两层俯视图:
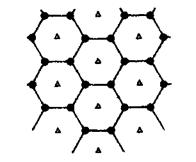
该材料的化学式为_______。
钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域。钴在化合物中通常以+2、+3的形式存在。
(1)写出基态Co原子的核外电子排布式 ;
(2)Co2+、Co3+都能与CN—形成配位数为6的配离子。CN—中碳原子的杂化方式为 ;1mol HCN分子中σ键的数目为 。
(3)Co的一种氧化物的晶胞如图所示(其中黑球代表Co),则该氧化物的化学式为 在该晶体中与一个氧离子等距离且最近的Co离子所形成的空间构型为 。
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4—,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN)6]3—,写出该反应的离子方程式 。
【化学一物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素n的基态原子的价电子排布式 ,元素O在周期表的位置是 ,属于 区。
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化方式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如左下图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如右下图乙所示。则晶胞中i原子的配位数为 。
喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( )
气体 |
溶液 |
|
A. |
H2S |
稀盐酸 |
B. |
HCl |
稀氨水 |
C. |
NO |
稀H2SO4 |
D. |
CO2 |
饱和NaHCO3溶液 |

A.AB.BC.CD.D