辽宁省葫芦岛市高二下学期市五校协作体期中化学试卷
现代化学中,常用来鉴定元素的方法
| A.红外光谱分析 | B.X-射线衍射实验 | C.质谱分析 | D.光谱分析 |
下列有关电子排布图的表述正确的是
A. 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 |
B.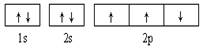 此图错误,违背了泡利原理 此图错误,违背了泡利原理 |
C. 表示基态N原子的价电子排布 表示基态N原子的价电子排布 |
D.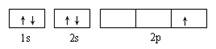 表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
原子核外电子排布式为[Ar] 3d54s2的元素是
| A.Cr | B.ds 区元素 | C.ⅡA族元素 | D.ⅦB族元素 |
氢元素形成的化合物种类众多,在下列化合物中,氢元素显示正价的是
| A.BH3 | B.SiH4 | C.C2H2 | D.NaH |
关于乙烯分子中的共价键,下列描述正确的是
| A.含有5个σ键、1个π键 |
| B.C-H之间是碳的sp2杂化轨道与H的s轨道形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| C.只有sp2杂化轨道才形成π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的σ键 |
有关氨气和甲烷分子空间构型叙述正确的是
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3为三角锥形,甲烷是正四面体形 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较弱 |
| D.NH3和CH4都是sp3型杂化,键角都是109°28′ |
有关氢键的叙述正确的是
| A.每一个水分子内平均含有两个氢键 |
| B.氢键与配位键一样,也是共价键的一种 |
| C.氢键是导致浓硫酸具有粘稠性原因之一 |
| D.由于H2O中含有氢键,因此水是一种非常稳定的化合物 |
石墨晶体是层状结构,下图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是
| A.10个 | B.14个 | C.18个 | D.24个 |
硫晶体熔化或气化时,下述各项中发生变化的是
| A.化学键 | B.中心原子杂化类型 |
| C.分子构型 | D.分子间作用力 |
下列各组分子中,都属于含极性键的非极性分子的是
| A.C2F4 CH3Cl | B.CO2 C2H2 |
| C.C60 S8 | D.NH3 PH3 |
下列晶体熔沸点由高到低的顺序正确的是
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
| A.①②③④⑤⑥⑦⑧ | B.①②⑤④③⑥⑦⑧ |
| C.①②⑤④③⑦⑥⑧ | D.⑥⑤④③②①⑦⑧ |
由第一电离能数据推断,最有可能生成稳定的单核阳离子的元素是
| |
氟 |
氯 |
溴 |
碘 |
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
A.氟 B.氯 C.溴 D.碘
氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为
| A.直线 sp杂化 | B.V型 sp2杂化 |
| C.三角锥形 sp3杂化 | D.平面三角形 sp2杂化 |
(6分)现代科技的高度快速发展离不开C和Si元素。
(1)写出Si的基态原子核外电子排布式__________________。
(2)从电负性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为______。
(3)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_____,微粒间存在的作用力是_______。
(4)C、Si为同一主族的元素,CO2、SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:_________________________
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3)X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构。
(1)有一种由铝、铜、铁三种元素构成的天然准晶体化合物,分析该准晶体组成的一种简单方法是先将该准晶体进行粉碎,然后按如下程序进行实验:
第1步:称取38.99 g 准晶体,让其与足量的NaOH溶液充分反应,在标准状况下,收集得到21.84 L 氢气。
第2步:将第1步反应后的浊液过滤出固体,用蒸馏水洗涤,逐滴滴入6mol/L盐酸,当加入的盐酸的体积为40mL时,固体不再溶解。
①铝、铁的第一电离能的大小关系为 (用元素符号表示)。
②根据以上实验可确定该准晶体的化学式为 。
(2)锰与一种短周期元素A形成的凝固态是一种准晶,已知A最外层电子数等于其电子层数,且其中含有成对和不成对电子。
①锰原子在基态时的核外电子排布式为 。
②锰与A在准晶体中的结合力为 。(离子键、共价键、金属键、分子间作用力)
③锰与A形成的准晶结构如图所示,则该准晶体的化学式为 。
④过渡金属配合物Mn2(CO)n的中心原子价电子数与配体提供电子总数之和为34,则n= 。
(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。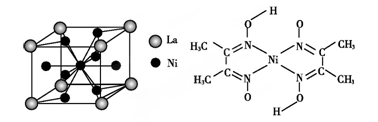
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
( 在5-氨基四唑(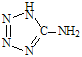 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为 ;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为 ;
在1mol 5-氨基四唑中含有的σ键的数目为 。
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为 。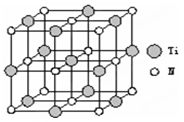
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 。(填写元素符号)
④[Ti(OH)2(H2O)4]2+中的化学键有 。
| A.σ键 | B.π键 | C.离子键 | D.配位键 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号