[四川]2013届四川省宜宾市高中高三第一次诊断性测试化学试卷
下列对化学与生产生活,化学与社会发展的认识不正确的是
| A.在工业生产中,采用低碳技术,降低能耗,能体现十八大提出的“绿色发展”理念 |
| B.油脂、氯乙烯和蔗糖都不是高分子化合物 |
| C.“45天速成鸡”又叫“激素鸡”,即养殖的鸡从孵出到端上餐桌只需45天,喂养过程中大 量使用抗生素,大量进食这样的鸡肉对人体健康有益 |
| D.含硫化石燃料的大量燃烧是酸雨形成的主要原因之一 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.1mol SiO2中含有NA个SiO2分子 |
| B.1mol Cu与足量的稀HNO3反应,转移2 NA个电子 |
| C.1 L0.1mol . L-1Na2CO3溶液中含有 0.1NA个CO32- |
| D.1mol苯乙烯中含有的碳碳双键数为4NA |
原子序数依次增大的X、Y、Z、W、M五种短周期元素,其中只有Y、Z、W同周期,X、M同主族;Y 的单质是最硬的物质;Z、W的单质为空气的主要成分。下列腿中正确的是
| A.X、M可以形成MX型离子化合物 |
| B.Y、Z、W三种元素的气态氢化物的沸点依次降低 |
| C.M2W2与X2W2的晶体是同种类型的晶体 |
| D.原子半径:M>W>Z>Y>X |
亮菌甲素为利胆解痉药,适用于急性胆囊炎治疗,其结构简式如右下图,下列有关叙述中正确的是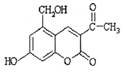
| A.分子中所有碳原子不可能共平面 |
| B.1mol亮菌甲素与溴水反应最多消耗3molBr2 |
| C.1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2molNaOH |
| D.1mol亮菌甲素在一定条件下可与6molH2发生加成反应 |
下列说法中正确的是
A.若M度T0C时水的离子积常数为KW在该温度下的中性溶液中c(H+)=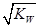 mol/L mol/L |
| B.25℃时HCl溶液中的c(H+)一定大于25℃时NH4Cl溶液中的c(H+) |
| C.1mol/LCH3COOH溶液和1mol • L-1KOH溶液等体积混合,混合溶液中c(K+)=c(CH3COO-) |
| D.pH =5.7的 NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法中正确的是
A.反应在t1 min内的平均速率为υ(CO2)=  mol·L-1·min-1
mol·L-1·min-1
B.到t1 min时,反应未达平衡状态
C. 保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为
| A.100mL | B.160mL | C.240mL | D.307mL |
常见元素A、B、C、D,其原子结构的相关信息如下表:
| 元素 |
相关信息 |
| A |
A原子的核外电子总数等于其基态电子层数 |
| B |
B原子的最外层电子数是次外层电子数的2倍 |
| C |
C的基态原子L电子层中有3个未成对电子 |
| D |
D的外围电子层排布为(n+1)d3n(n+2)sn |
请回答下列问题:
(1)A的原子结构示意图是_______;D元素位于周期表第______周期 ______族。
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足______(填字母序号),分子中所有的原子就有可能在同一个平面内。
A.sp3或sp2杂化轨道
B.sp3或sp杂化轨道
C.sp或sp2杂化轨道
(3)如图,在B晶体的一个晶胞中含有______个B原子。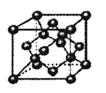
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3。
①CA3分子是______(填“极性”或“非极性”)分子。
②写出制备C2A4的总反应方程式____________
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):______________________________
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)  2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
| A.υ(O2)正=2υ(SO2)逆 |
| B.容器中气体的总质量不随时间而变化 |
| C.容器中气体的颜色不随时间而变化 |
| D.容器中气体的压强不随时间而变化 |
(2)下列关于反应2SO2(g)+O2(g)  2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。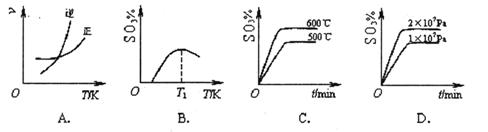
(3)某温度下SO2(g)+ 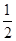 O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
(14分)塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂。增塑剂 DEHP(C24H38O4)可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子。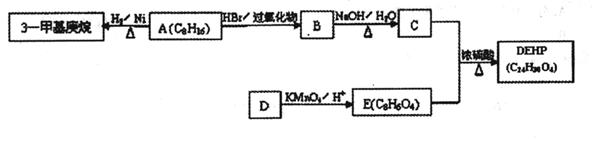
已知:
回答下列问题:
(1)E的结构简式是______ 。
(2)B→C的反应类型是____________
(3)3—甲基庚烷的某同分异构体核磁共振氢谱显示只有一种氢,写出该同分异构体的结构简式并命名:
①结构简式____________
②命名____________
(4)DEHP的结构简式是____________
(5)F是E的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液呈紫色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式:____________________________________
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下: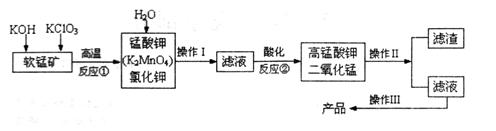
(1)操作Ⅱ的名称是____________。
(2)可循环利用的物质____________(填化学式)。
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。
(4)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
A.稀盐酸 B.稀硫酸 C.稀醋酸
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)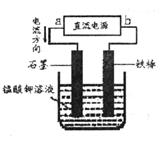
 粤公网安备 44130202000953号
粤公网安备 44130202000953号