焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2 Na2S2O5。
Na2S2O5。
(1)a仪器的名称为: ,实验前要进行 。
装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)浓硫酸 (填“能”或“不能”)用稀硫酸代替,原因是 。
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(4)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”、“偏低”或“不变”)。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)按照甲同学的观点,发生反应的离子反应方程式为 ;
(2) 在探究沉淀成分前,须将沉淀从溶液中通过过滤、洗涤、干燥等步骤分离并净化。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分是何种成分。

(3)B中试剂为 。
(4)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,还可利用下列装置通过实验测定其组成。
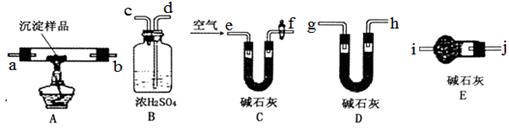
(5)各装置连接顺序为 e→f→ →j。(填字母序号)
(6)装置C中碱石灰的作用是 ,实验开始和结束时都要通入足量的空气,请说明结束时通入足量空气的作用是 。
(7)若沉淀样品的质量为m克,装置B质量增加了n克,则样品中CuCO3的质量分数为 。
某化学小组在实验室模拟高炉炼铁,其部分装置如下:
请完成下列填空:
(1)利用甲酸与浓硫酸反应HCOOH CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
(2)判断上述装置中CO与氧化铁发生反应的现象为____________;该装置存在的缺陷是__________。
(3)已知受热不均时,可发生副反应CO+Fe2O3 CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
①样品和稀硫酸应分别置于________、_________仪器中(填“甲”或“乙”),甲、乙试管中接口的连接方式为:A连接_______,B连接_______,C连接F(填各接口的编号)。
②量气管可以用化学实验室中一种常用仪器来改装,该仪器的名称是___________。当气体不再产生且恢复至室温时,如丙图所示量气管读数______________mL。若量气之前的其他操作均正确,根据该读数并将产生的气体体积换算为标准状况后,所计算样品中铁的质量分数将__________(填“偏大”、“偏小”或“无影响”),原因是______(若无影响该空不必作答)。
下图是丁烷裂解的实验流程:(提示:丁烷在一定条件下裂解的可能方程式为:
C4H10 C2H6+C2H4, C4H10
C2H6+C2H4, C4H10  CH4+C3H6)
CH4+C3H6)
连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…‥
(1)这三步操作的先后顺序依次是 ;
(2)简要说明排空气的方法______________。
(3)写出甲烷与氧化铜反应的化学方程式
(4)若对E装置中的混合物(溴水足量),再按以下流程实验:
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ______Ⅱ______,Na2SO3溶液的作用是(用离子方程式表示) .
②已知B的碳原子数大于A的碳原子数请写出B的结构简式 .
(5)假定丁烷完全裂解当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) =______(假定流经D、G装置中的气体能完全反应)
与
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
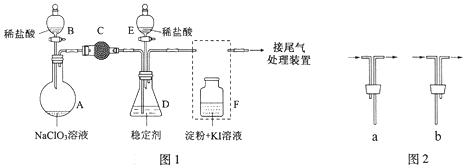
(1)仪器的名称是。安装
中导管时,应选用图2中的。
(2)打开的活塞,A中发生反应:
+
=
↑+
↑+
+
。
为使在
中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填"快"或"慢")。
(3)关闭的活塞,
在
中被稳定剂完全吸收生成
,此时
中溶液的颜色不变,则装置
的作用是。
(4)已知在酸性条件下NaClO2可发生反应生成并释放出
,该反应的离子方程式为,在
释放实验中,打开
的活塞,
中发生反应,则装置
的作用是 。
(5)已吸收气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是,原因是 。

高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

Ⅰ(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通人适量CO2,发生反应生成KMn04和Mn02和碳酸盐,则发生反应的离子方程式为______________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_____________________
(4)H2O2和KMn04都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,该反应中氧化产物与还原产物的物质的量之比为 。
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质。

(5)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
(6)若装置B中装有5.0 mL l.0 mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为
(7)探究SO2的性质时,E装置中以NaOH溶液吸收尾气,实验结束后,E装置中可能含有的溶质为___________________(以化学式作答).
是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料]在260
和400
时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)

实验1:连接装置,检查气密性,按图示加入试剂(装置
盛0.5000
盐酸70.00
)。通入
排尽空气后,于260
加热装置
一段时间,停止加热,冷却,停止通入
。品红溶液不褪色,取下装置
,加入指示剂,用0.2000
溶液滴定剩余盐酸,终点时消耗
溶液25.00
。经检验滴定后的溶液中无
。
(1)仪器的名称是。
(2)滴定前,下列操作的正确顺序是(填字母编号)。
a.盛装0.2000溶液
b.用0.2000溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置内溶液吸收气体的物质的量是
实验2:连接装置
,检查气密性,按图示重新加入试剂。通入
排尽空气后,于400
加热装置
至
完全分解无残留物,停止加热,冷却,停止通入
。观察到装置
、
之间的导气管内有少量白色固体。经检验,该白色固体和装置
内溶液中有
,无
。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置内溶液中有
,无
的实验操作和现象是.
(5)装置内溶液吸收的气体是.
(6)在400
分解的化学方程式是.
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式:__________________,B的作用:_____________;C中热水的作用:_____________________。
(2)M处发生反应的化学方程式为_________________。
(3)从M管中可观察到的现象:_______________,从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的_____________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应 ________ (填“能”或“不能”)继续进行,其原因是_____________。
(5)验证乙醇氧化产物的化学方法是______________________。
我校高一化学兴趣小组的同学们为探究铁与浓硫酸的反应,设计了如图所示装置进行实验。

(1)实验过程中,观察到B中的实验现象是 ;写出C中发生反应的离子方程式 。
(2)浓硫酸与足量的铁丝反应一段时间后,若观察到从C中有少量的气泡冒出,此气泡的成分是 。试分析产生该气体的原因 。
(3)用“可抽动的铁丝”代替“直接投入铁片”的优点是 ;
(4)反应一段时间后,他们对A中溶液的金属阳离子进行了探究
①提出假设:
假设1: ;
假设2: ;
假设3:溶液中存在Fe2+和Fe3+。
②已知假设3是正确的,选择合适的试剂,设计实验验证上述假设3,写出实验操作步骤、实验现象及结论。限选试剂:稀HNO3、氯水、酸性KMnO4溶液、NaOH溶液、KSCN溶液。
| 实验操作步骤 |
实验现象 |
结论 |
| Ⅰ ; |
; |
溶液中存在Fe3+; |
| Ⅱ 。 |
。 |
。 |
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器 (内含物质)组装成实验装置[已知:酸性H2SO3>H2CO3,Ca(HSO3)2溶于水]:
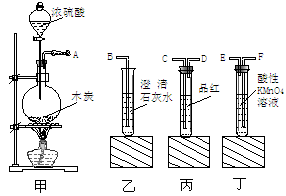
(1)甲中反应的化学方程式为: 。
(2)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母): 接 , 接 , 接 。
(3)要检验出CO2,实验现象是:乙中 ,丙中 。
(4)丁中酸性KMnO4溶液的作用是 ;丙中品红的作用是 。
如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶中所装试剂为:B(碘化钾淀粉溶液)、C(紫色石蕊试液)、D(FeCl2溶液)、E(水)。
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为________________。
(2)F装置的作用为_____________;F装置瓶内宜加入的液体是________________。
(3)实验开始后B中的现象是_______________,C中的现象是________________。
(4)写出D中反应的化学方程式:__________________________________________。
(5)用量筒量取20 mL E中溶液,倒入已检漏的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是_____________(填“上层液”或“下层液”),再装入烧杯中,能使有色布条褪色的是_____________(填“上层液”或“下层液”)。
某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
| 装置 |
序号 |
试管中的药品 |
现象 |
持续通入 |
实验Ⅰ |
1.5 mL 1 mol·L-1 CuSO4溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 |
开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ |
1.5 mL 1 mol·L-1 CuCl2溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 |
开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(1)制取新制Cu(OH)2悬浊液的离子方程式为 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明: 。检验Cu(OH)2洗涤干净的方法是 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)2+ +Cl- + 2H2O 、 ____________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:
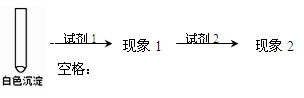
填写下表空格:
| 试剂1 |
|
试剂2 |
蒸馏水 |
| 现象1 |
|
现象2 |
|
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式: 。
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中, _______________ ,则说明砖红色沉淀是Cu2O。
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按下图装置(固定装置已略去)进行实验
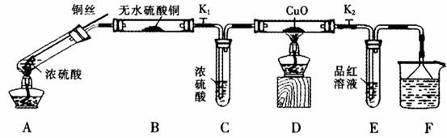

(1)A中反应的化学方程式为: 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(5)某同学想用SO2气体进行喷泉实验(装置如图所示),烧杯中的溶液可以为 (填序号)
a.NaOH溶液 b.饱和NaHSO3溶液 c.氯水 d. KMnO4溶液
实验Ⅱ:反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___________
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:[SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。


(3)装置B中试剂的作用是___________________
(4)认为气体Y中还含有Q的理由是________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法?做出判断并说明理由__________
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。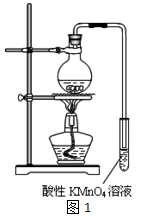
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为(只写主要发生的反应): 。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
① 。
② 。