福建省四地六校高三上学期第二次联考化学试卷
下列说法中正确的是
| A.PM 2.5、二氧化碳都属于空气质量日报的内容 |
| B.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
| C.对“地沟油”进行分馏可得到汽油 |
| D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.42g乙烯和丙烯的混合气体中碳原子数目一定为3NA。 |
| B.用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体。 |
| C.配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容。 |
| D.30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA。 |
下列离子方程式书写正确的是
| A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O。 |
| B.Fe2O3溶于氢碘酸: Fe2O3+6H+=2Fe3++3H2O |
| C.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4+ + OH-=H2O+NH3↑ |
| D.二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O=4H++2Br -+SO42- |
某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①少量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
| A.一定没有CO2,肯定有H2 |
| B.一定有CO、CO2和水蒸气 |
| C.可能有CO2、NH3和水蒸气 |
| D.一定有H2、CO2和HCl |
有人说假设与猜想是科学探究的先导和价值所在。 下列假设引导下的探究肯定没有意义的是
| A.探究Na与水的反应可能有O2生成。 |
| B.探究SO2和Na2O2反应可能有Na2SO4生成。 |
| C.探究足量的铜与一定量的浓硝酸反应的气体产物是NO还是NO2。 |
| D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致。 |
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
下列有关物质的应用与性质相对应的说法正确的有几个
①明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有强氧化性
②氯化铁溶液可用于制作印刷电路板是因为其能氧化单质铜
③浓硫酸可用作干燥剂是因为其具有脱水性
④光导纤维可用作通讯材料是因为其具有导电性
⑤MgO、Al2O3的熔点很高,可制作耐高温材料
⑥NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂
⑦Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
| A.3个 | B.2个 | C.5个 | D.4个 |
化学与生活密切相关。下列应用中利用了物质氧化性的是
| A.铁盐制胶体 | B.纯碱去油污 | C.食醋除水垢 | D.漂白粉漂白织物 |
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

| 选项 |
X |
Y |
Z |
箭头上所标数字的反应条件 |
| A |
CaO |
Ca(OH)2 |
CaCO3 |
①常温加水 |
| B |
AlCl3 |
NaAlO2 |
Al(OH)3 |
②通入CO2 |
| C |
Fe |
FeCl2 |
FeCl3 |
④加入铁粉 |
| D |
Cl2 |
Ca(ClO)2 |
HClO |
③加浓盐酸 |
下列实验“操作和现象”与“结论”都正确的是
| |
操作和现象 |
结论 |
| A |
切开金属钠,钠表面的银白色会逐渐变暗 |
Na在空气中会生成Na2O2 |
| B |
向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 |
Fe(NO3)2与H2SO4不反应 |
| C |
SO2通入酸性KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
| D |
将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 |
从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
用下列实验装置进行相应实验,能达到实验目的的是
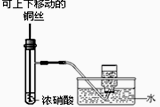
图1 图2 图3 图4
| A.用图1所示装置,制备并收集少量NO2气体 |
| B.用图2所示装置,除去CO2中的HCl |
| C.用图3所示装置,制备Fe(OH)2并能较长时间观察其颜色 |
| D.用图4所示装置,所示装置制取并收集干燥纯净的NH3 |
为了防止NO、NO2、N2O4对大气的污染,常用氢氧化钠溶液进行吸收处理,反应的化学方程式2NO2+2NaOH=NaNO3+NaNO2+ H2O,NO2+NO+2NaOH=2NaNO2+H2O。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体,能被1.0 mol·L-1的氢氧化钠溶液完全吸收,则消耗氢氧化钠溶液的体积最小为
| A.(a+b+c)L | B.2(a+b+c)L | C.(a+b+2c)L | D.3(a+b+c)L |
在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3,铜粉可溶解的是
| A.①② | B.②④ | C.②③ | D.①④ |
常温下,下列各组离子在指定的条件下一定能大量共存的是
| A.水电离的氢离子浓度为10-6 mol/L的溶液中:Na+、HCO3- 、Br -、Cl- |
| B.pH=7的溶液中:Fe3+、Cu2+、Cl-、SO42- |
| C.使酚酞变红的溶液中:Ba2+、Cl-、Na+、NO3- |
| D.加入铝粉产生氢气的溶液:Na+、Cu2+、Cl-、NO3- |
已知I2+SO32-+H2O=SO42-+2I-+2H+。某无色溶液中可能含有I-、NH4+、Ba2+、SO32-、MnO4-中的一种或几种,若向该溶液中滴加少量的溴水,溶液仍为无色,下列判断正确的是
| A.该溶液中肯定不含I- |
| B.该溶液中可能含有Ba2+ |
| C.该溶液中肯定含有NH4+ |
| D.该溶液中可能含有MnO4- |
由NO、H2、CO2组成的混合气体,通过足量的Na2O2充分反应后,再用电火花引燃使其充分反应后,最终只得到质量分数为70%的硝酸,无其他气体剩余。则原混合气体中NO、H2、CO2的体积比
| A.2:4:3 | B.2:4:5 | C.2:4:7 | D.3:5:8 |
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。关于混合粉末的组成判断正确的是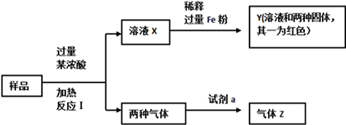
A.一定含CuO和C
B.一定含Fe2O3、CuO和C
C.一定含CuO和C,一定不含Al
D.气体Z为纯净物
进行下列反应后,所得溶液中一定只含有一种溶质的是
| A.将铁粉加到稀硝酸中 |
| B.向稀盐酸中滴入少量的NaAlO2溶液 |
| C.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 |
| D.室温下,NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液 |
下列实验过程中产生的现象与右边座标图形相符合的是
| A.稀盐酸滴加到一定量NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量) |
| B.铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量) |
| C.CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力) |
| D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力) |
a mol FeS与b mol FeO投入到V L c mol·L-1的硝酸溶液中,恰好完全反应,还原产物只有NO,所得澄清溶液可看作是Fe(NO3)3与H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g
②(a+b)×189g
③(a+b)mol
④(Vc-3a-b/3)mol
| A.②④ | B.②③ | C.①③ | D.①④ |
实验室配制FeSO4溶液通常需要加入少量稀硫酸与铁屑。完成下列填空:
(1)加入铁屑的目的是: ;加入稀硫酸的目的是: 。
(2)有一瓶未加稀硫酸与铁屑的FeSO4溶液,在空气中放置一段时间后,溶液颜色变黄且有红褐色浑浊。写出并配平上述变化的化学反应方程式:__________________
(3)上述反应中的还原产物是: 。
(4)现有1.2L含3mol FeSO4的溶液恰好与0.6 mol HIO3完全反应,则还原产物是 。如果改用HBrO3恰好与上述FeSO4的溶液反应,则最少消耗的HBrO3 (填“大于”、“小于”或“等于”) 0.6 mol。理由是 。
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出F的电子式____________________________________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是___________________
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的____________溶液再与盐酸反应,如图所示,则A与B溶液反应后溶液中的溶质化学式为______________________________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是______________________________。
(5)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是____________________________。
(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为___________________________。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。

(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规 格是___________(以序号作答)。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为: 。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g。量气瓶中收集到VmL气体,请写出a、b、v的代数关系式:____________________________
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)= ____________ ___(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将 (填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
① ② ③
高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

Ⅰ(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通人适量CO2,发生反应生成KMn04和Mn02和碳酸盐,则发生反应的离子方程式为______________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_____________________
(4)H2O2和KMn04都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,该反应中氧化产物与还原产物的物质的量之比为 。
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质。

(5)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
(6)若装置B中装有5.0 mL l.0 mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为
(7)探究SO2的性质时,E装置中以NaOH溶液吸收尾气,实验结束后,E装置中可能含有的溶质为___________________(以化学式作答).
 粤公网安备 44130202000953号
粤公网安备 44130202000953号