为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按下图装置(固定装置已略去)进行实验


(1)A中反应的化学方程式为: 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(5)某同学想用SO2气体进行喷泉实验(装置如图所示),烧杯中的溶液可以为 (填序号)
a.NaOH溶液 b.饱和NaHSO3溶液 c.氯水 d. KMnO4溶液
实验Ⅱ:反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。





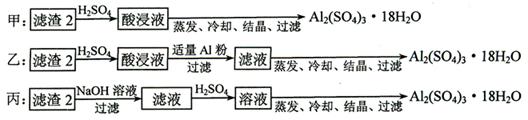
 的装置制备
的装置制备 ,应选择的试剂为.
,应选择的试剂为. 需用
需用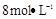 的盐酸1OOml,现用
的盐酸1OOml,现用 的盐酸来配制。
的盐酸来配制。 L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。


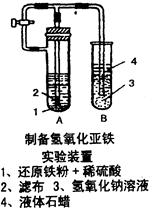
 粤公网安备 44130202000953号
粤公网安备 44130202000953号