在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是
| A.锌作阳极,镀件作阴极,溶液中含有锌离子 |
| B.铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D.锌作阴极,镀件作阳极,溶液中含有亚铁离子 |
如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是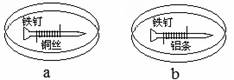
| A.a中铁钉附近呈现红色 | B.b中铁钉上发生还原反应 |
| C.a中铜丝上发生氧化反应 | D.b中铝条附近有气泡产生 |
下列有关金属腐蚀与防护的说法正确的是
| A.在铁门上焊接铜块能防腐蚀 |
| B.镀锡铁制品的镀层破损后,镀层仍能对铁制品起保护作用 |
| C.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| D.在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列叙述错误的是( )
| A.氢氧燃料电池是一种将化学能转化为电能的装置 |
| B.铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 |
| C.钢铁腐蚀时负极的电极反应式:Fe-3e-=Fe3+ |
| D.工业上电解饱和食盐水时阴极的电极反应式:2H++2e-=H2↑ |
把锌片和铁片放在盛有食盐水和酚酞试液的表面皿中,装置如下图。观察到溶液首先变红色的区域是
| A.Ⅰ和Ⅲ | B.Ⅰ和Ⅳ | C.Ⅱ和Ⅲ | D.Ⅱ和Ⅳ |
下列说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 |
C.对于反应①C+CO2 2CO(△H>0)和反应②N2+3H2 2CO(△H>0)和反应②N2+3H2 2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢 2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢 |
| D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
| B.向酒精灯内添加酒精时,不能多于容积的2/3,若不慎洒出的酒精在桌上燃烧,应迅速用水灭火 |
| C.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合 |
| D.在“金属析氢腐蚀”实验中,外面缠绕着铜丝的铁钉上产生气泡多,在铁钉周围出现血红色现象(溶液中滴加几滴KSCN溶液) |
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢材年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________
(2)为了降低某铁闸门被腐蚀的速率,可以采用上述图甲所示的方案,其中焊接在铁闸门上的固定材料R可以采用____(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)上图乙所示的方案也可以降抵铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_______极。
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+ |
拴上金属条的铁钉插在含有酚酞的NaCl溶液中,如图所示,可以看到在贴近金属条一边的溶液出现粉红色。该金属条可能是
| A.镁 | B.铝 | C.锌 | D.铜 |
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象可能出现的是
| A.B中导气管中产生气泡 | B.B中导气管里形成一段水柱 |
| C.锥形瓶中溶液无色 | D.铁被腐蚀 |
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中负极电极反应相同 |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的pH值 (填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是 ,该电极电极反应式为 ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 。