山东省青岛平度市三校高二上学期期末考试化学试卷
下列说法中,正确的是
| A.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)<Ksp(AgI) |
| B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
| C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大 |
| D.强电解质的水溶液中不存在分子 |
下列事实中,不能用勒沙特列原理来解释的是
| A.除去CuCl2溶液中的Fe3+,通常是向其中加入CuO、Cu(OH)2等固体 |
B.对于反应H2(g)+I2(g)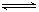 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
下列实验操作或对实验事实的叙述中存在错误的是
| A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 |
| B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| C.酸碱中和滴定时,锥形瓶未用待装液润洗。 |
| D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。 |
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8KJ/mol |
| B.已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定 |
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+ H2SO4(ag)= H2SO4(ag)=  Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol |
D.己知C(s)+ O2(g)= CO2(g);△H1C(s)+ O2(g)= CO(g);△H2则△H1>△H2 O2(g)= CO(g);△H2则△H1>△H2 |
下列表示对应化学反应的离子方程式正确的是
A.硫化钠溶于水中:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+ H2O |
| C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D.NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O |
如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
下列比较中,正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则等浓度等体积的NaF溶液比 NaCN 溶液中阴子总数少
B.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+)
C.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>④>③
下列实验方案不能证明醋酸是弱电解质的是
| A.往0.10 mol/L CH3COOH溶液中加CH3COONa固体,pH增大 |
| B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,两者的pH相差小于1个单位。 |
| C.对盐酸和醋酸溶液进行导电性实验,与CH3COOH溶液相串联的灯泡较暗。 |
| D.室温,PH=3的醋酸与PH=11的NaOH溶液等体积混合,溶液PH<7。 |
反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的NO2的体积分数:C > A
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若p2 > p1,则化学平衡常数KA > KC
下列各组离子一定能大量共存的是
| A.由水电离出的c(H+)=1×10-14mol/L的溶液中: K+、I-、Cl-、NO3- |
| B.在呈中性的溶液中:Al3+、Na+、CO32—、Cl— |
| C.在pH=12的溶液中NH4+、Na+、SO42-、Cl- |
| D.在c(H+)=0.1 mol·L-1的溶液中Fe3+、K+、Cl-、NO3- |
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象可能出现的是
| A.B中导气管中产生气泡 | B.B中导气管里形成一段水柱 |
| C.锥形瓶中溶液无色 | D.铁被腐蚀 |
某二元酸H2A在水中发生电离:H2A=H++HA-,HA- H++A2-。下列叙述中不正确的是
H++A2-。下列叙述中不正确的是
A.在NaHA溶液中c(Na+)>c (HA-)> c(H+) >c (OH-)
B.在Na2A溶液中c (Na+)="2c" (A2-)+2c(HA-)+2c (H2A)
C.在Na2A溶液中c (OH-) ="c" (HA-)+ c (H+)
D.在H2A溶液中c (H+)="c" (HA-)+2c (A2-)+c (OH-)
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是
| A.含有大量SO42-的溶液中肯定不存在Ag+ |
| B.Ag2SO4的溶度积常数(Ksp)为8×10-4 |
| C.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D.0.02mol•L-1的AgNO3溶液与0.2mol•L-1的Na2SO4溶液等体积混合不会生成沉淀 |
常温下,浓度均为0.1mol·L-1的三种溶液:①CH3COOH 溶液 ②NaOH 溶液 ③CH3COONa溶液。下列说法不正确的是
| A.溶液的pH :②>③>① |
| B.水电离出的c(OH- ):③>①>② |
| C.①和③等体积混合后的溶液:c(H+)+c(CH3COOH) =c(OH- )+c(CH3COO-) |
| D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.05mol·L-1 |
下列图示与对应叙述相符合的是
A.图I:反应CO+NO2 CO2+NO达平衡后,升高温度时反应速率随时间的变化 CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
B.图Ⅱ:反应2SO2+O2 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
C.图Ⅲ:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系 2NH3在恒温情况下,反应速率与压强的关系 |
D.图Ⅳ:反应CO2(g)+H2(g) CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化[ CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化[ |
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
| A.混合溶液可能显示酸性、碱性或中性 |
| B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O) |
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为 mol·L-1 mol·L-1 |
(12分)(1)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: 。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为 ,滴定终点时的颜色变化为 。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果 。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为 。
(8分)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为:
②当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3·H2O)_______n(HCl),溶液中c( NH4+)_______c(Cl-)。(填“>”或“<”或“=” )
(2)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_ __和_ _两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
(9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)N的电极反应式为 :
乙池的总化学方程式是 ,
加入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为200mL,则乙池中溶液的H+的浓度为 。
在一个1 L的密闭容器中,加入2 mol A和1 mol B,发生下列反应:
2A(g) + B(g)  3C(g) + D(s), 达到平衡时,C的浓度为1.2 mol·L-1。
3C(g) + D(s), 达到平衡时,C的浓度为1.2 mol·L-1。
(1)维持容器的温度不变,若将容器的体积缩小至一半,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),C的浓度为 mol/L,平衡常数K= 。
(2)能说明该反应达到化学平衡状态的是
a.容器中气体总压强不再改变 b.容器中气体的密度不再改变
c.2V正(A)=3V逆(C) d.气体平均相对分子质量不再改变
(3)维持容器的压强和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol·L-1的是 。
a.4 mol A + 2 mol B
b.3 mol C + 1 mol D
c.2 mol A +1 mol B + 1 molD
(4)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2 mol·L-1,则C的起始物质的量应满足的条件是 。
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_______ _,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1 mol/L NaHCO3 ②100ml 0.1 mol/L Na2CO3两种溶液,溶液中水电离出的H+个数:
① ②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:① ②
(3)NaHCO3是一种 (填“强”或“弱”)电解质;写出HCO3―水解的离子方程式: ,常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用NaOH来进行洗气和提纯。
①当150ml 1mol/L的NaOH溶液吸收标准状况下2.24LCO2时,所得溶液中各离子浓度由大到小的顺序为
②几种离子开始沉淀时的PH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
Ksp[Fe(OH)2] Ksp[Mg(OH)2] (填“>”、“=”或“<”),要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。(KspCu(OH)2=2×10-20mol2·L-2)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号