下列事实不能用金属活动性解释的是:
| A.生活中可用铝制的水壶烧水 |
| B.镀锌铁制品破损后,镀层仍能保护铁制品 |
| C.工业上常用热还原法冶炼铁,用电解法冶炼钠 |
| D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部 |
制造焊锡时,把铅加进锡的重要原因是
| A.增加强度 | B.降低熔点 | C.增加硬度 | D.增强抗腐蚀能力 |
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
| A.此腐蚀过程有化学腐蚀也有电化学腐蚀 |
| B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-=4OH- |
| C.在化学腐蚀过程中有氢气产生 |
| D.发生电化学腐蚀时的负极反应为Fe=Fe2++2e- |
下列与金属腐蚀有关的说法中,不正确的是
| A.钢铁在潮湿空气中生锈属于电化学腐蚀 |
| B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 |
| C.金属腐蚀的本质是金属原子失去电子被氧化的过程 |
| D.铝具有强抗腐蚀能力,是因为其不易与氧气发生反应 |
下列关于金属腐蚀与防护的说法正确的是
| A.古代青铜文物在干燥环境中的腐蚀比潮湿环境中快 |
| B.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用 |
| C.将钢闸门与直流电源的正极相连可防止其被腐蚀 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
化学品船是建造或改装用于运载各种有毒、易燃、易挥发或有腐蚀性的化学物质的货船,下列说法错误的是
| A.在船舶的底部四周镶嵌铜块以保护船体 |
| B.不锈钢船舱可储藏运输散装氢氧化钠溶液 |
| C.甲醇与浓硫酸必须分开储藏运输 |
| D.造船焊接钢板时可用二氧化碳保护气 |
下列叙述正确的是
| A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
| B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 |
| D.牺牲阳极的阴极保护法和外加直流电的阴极保护法都是应用电解原理 |
下列物质的有关事实与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属镁、铝的表面可形成一层氧化膜 |
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:

(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
建筑用的钢材在出厂前都要经过烤蓝处理,使其表面生成一层四氧化三铁,其目的是
| A.增加钢材的硬度 | B.增强钢材的抗腐蚀能力 |
| C.使钢材美观 | D.增加钢材的韧性 |
下列叙述正确的是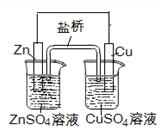
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.上图Zn为负极,发生还原反应 |
| C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O |
钢铁在潮湿的空气中会被腐蚀,发生的反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是
| A.负极发生的反应为Fe-2e-===Fe2+ |
| B.正极发生的反应为2H2O+O2+2e-===4OH- |
| C.原电池是将电能转化为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
钢铁发生电化腐蚀时,正极上发生的反应是
| A.2H++2e-=H2↑ | B.2H2O+O2+4e-=4OH- |
| C.Fe-2e-=Fe2+ | D.4OH--4e-=O2↑+2H2O |