下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是
| A.在含铁元素较多的酸性土壤中 | B.在潮湿疏松透气的土壤中 |
| C.在干燥致密不透气的土壤中 | D.在含碳粒较多、潮湿透气的土壤中 |
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:

(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
建筑用的钢材在出厂前都要经过烤蓝处理,使其表面生成一层四氧化三铁,其目的是
| A.增加钢材的硬度 | B.增强钢材的抗腐蚀能力 |
| C.使钢材美观 | D.增加钢材的韧性 |
下列叙述正确的是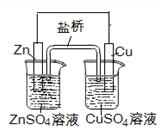
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.上图Zn为负极,发生还原反应 |
| C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O |
右图实验为研究金属腐蚀的实验,下列相关说法正确的是
| A.食盐水中有气泡逸出 |
B.铁表面的反应为 |
| C.红色首先在食盐水滴的中心出现 |
| D.该实验研究的是金属的吸氧腐蚀 |
钢铁在潮湿的空气中会被腐蚀,发生的反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是
| A.负极发生的反应为Fe-2e-===Fe2+ |
| B.正极发生的反应为2H2O+O2+2e-===4OH- |
| C.原电池是将电能转化为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
钢铁发生电化腐蚀时,正极上发生的反应是
| A.2H++2e-=H2↑ | B.2H2O+O2+4e-=4OH- |
| C.Fe-2e-=Fe2+ | D.4OH--4e-=O2↑+2H2O |
下列各种方法中,能对金属起到防止或减缓腐蚀作用的是
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥
④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
| A.①②③④ | B.①③④⑤ |
| C.①②④⑤ | D.全部 |
潜艇的金属外壳浸在海水中,在海水和空气的作用下会 被腐蚀
被腐蚀
(1)若海水呈中性,一艘钢制外壳的潜艇在海水中发生腐蚀的电极反应式为:
正极:___________________________________________________________ ______ _,负极:__________________________________________________________。
______ _,负极:__________________________________________________________。
(2)为有效地保护潜艇。下列措施中最好的是______________(填序号)
| A.采用纯铁制造潜艇外壳 | B.采用耐腐蚀的合金制造潜艇外壳 |
| C.在潜艇上涂一层油 | D.在潜艇外壳上装一定数量的锌块 |
在稀硫酸中插入一块铁片,再加入下列物质,可使铁片迅速发生腐蚀的是 ( )
| A.稀盐酸 | B.氢氧化钠固体 | C.硫酸铜晶体 | D.氯化钾晶体 |
烧过菜的铁锅未及时洗涤(残液中含有食盐等),第二天便出现红棕色锈斑,下列反应中不属于上述整个过程中可能发生的变化的是
| A.2H2O + O2 + 4e → 4OH— | B.Fe2+ + 2OH— → Fe(OH)2↓ |
| C.Fe - 3e → Fe3+ | D.4Fe(OH)2+O2+2H2O→4Fe(OH)3↓ |
下列说法正确的是
| A.在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol |
| B.钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同 |
| C.参加反应的物质的性质是决定化学反应速率的重要因素 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.④>②>①>③ | B.②>①>③>④ |
| C.④>②>③>① | D.③>②>④>① |