下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为 。
(2)B中各电极的电极反应式:负极: ;正极: 。
(3)C中被腐蚀的金属是 ,正极反应 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。
烧过菜的铁锅未及时洗去含有NaCl的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为Fe(OH)3失水的产物。铁锅的锈蚀主要属于 (填“析氢”或“吸氧”)腐蚀。
(1)请你表示此时Fe被腐蚀的电极反应式:负极 ,正极 .
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式
(3)发生原电池反应生成Fe(OH)2的总反应式为
(4)Fe(OH)2与O2和水反应转化为Fe(OH)3,然后进一步转化为铁锈的化学方程式:
。
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为 。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是 、 (填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②E装置的作用是 ,
上述装置最后尾气处理的方法是 。
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = 。
④在本实验中,下列情况会使测定结果n偏大的是 (填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
对照试验是化学研究中常用的一种方法。某研究小组对铁生锈进行如下研究。
(1)经过较长时间后发现:上述图中的铁钉最容易生锈的是 。
(2)在铁钉的锈蚀过程中,Fe发生了 (填“氧化”或“还原”)反应。
(3)铁生锈的外部条件是 。
(4)钢铁工业史国家工业的基础。下列措施能起到防腐作用的是 。
A.刷油漆 B.包上一层塑料层 C.连接一定数量镁块
(1)P4(白磷,s)+5O2(g)══ P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ,
相同状况下,红磷的稳定性比白磷 (填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做 极,发生 反应;
电解池中,与电源正极相连的极是 极,发生 反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
①若试管内液面上升,发生 腐蚀,正极反应式为 。
②若试管内液面下降,发生 腐蚀,正极反应式为 。
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业铝热法炼铁的主要化学反应方程式 。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:①铁锅的腐蚀主要是由 腐蚀造成的。
②铁锅锈蚀的负极反应式为 。
(3)通常使用钢铁是铁和__________的合金;当马口铁(表层镀锡)镀层被损坏后,这时被腐蚀速度比普通铁_______(填“快”或“慢”)。为防止轮船的船体在海水中腐蚀,一般在船身连接 (填“锌块”或“铜块”)
(共8分)中国是世界上最早研究和生产合金的国家之一。合金是被广泛使用的金属材料。
(1)金属腐蚀的现象非常普遍。造成钢铁腐蚀的主要原因是 腐蚀,其负极反应式为 。请例举两种防止铁制品被腐蚀的方法 、 。
(2)钢一般可分为碳素钢和 两大类。根据含碳量的不同,碳素钢可分为 、 和 。
用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,该种腐蚀属 ,反应的电极反应式为 。若用铝制饭盒盛放食盐(含水时),一段时间后,饭盒被腐蚀,这种腐蚀叫做 ,反应原理是(写电极反应式) 。
金属是人类生产、生活中不可缺少的重要材料
(1)生铁是 (填化学式)和铁的合金,生铁的硬度比纯铁 (填高、低)。
(2)生铁放置在潮湿的空气发生电化学腐蚀时的正极反应为 ;负极反应为 ;用盐酸可以除去生铁表面的铁锈,该反应的离子方程式为 。
(3)下列对金属制品采取的防护方法不正确的是 (填序号)。
①在电线的外面包上一层塑料层
②在自行车钢圈上镀上一层金属铬
③在海轮的铁制外壳上焊上铜块
④在铁制的暖气片上刷一层油漆
(6分)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
在空气酸度不大的环境中,其负极是 ,负极反应式为 ;
正极是 ,正极反应式为 。
(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 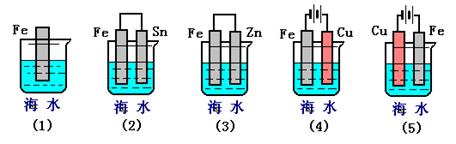
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,该原电池的负极是 ,负极反应式为 ;正极是 ,正极反应式为 。
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示) 
(8分)钢铁很容易生锈而被腐蚀。
(1)钢铁腐蚀主要是吸氧腐蚀,吸氧腐蚀过程中的电极反应为:
负极_______________ _______________;
正极_______________________________ 。
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 _________(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极上。