Ⅰ、铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为_____________,
②图中A、B、C、D、四个区域,生成铁锈最多的是__________(填字母).
(2)已知:Fe(s)+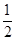 O2(g)═FeO(s)△H=-272kJ•mol-1
O2(g)═FeO(s)△H=-272kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
则高炉炼铁过程中FeO(s)+CO(g)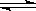 Fe(s)+CO2(g)△H=__________。
Fe(s)+CO2(g)△H=__________。
Ⅱ、甲醇是一种重要的化工原料和新型燃料。下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.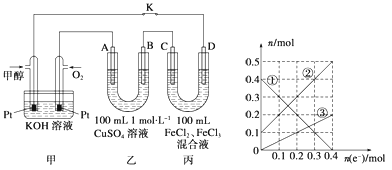
(1)甲中负极的电极反应式为__________。
(2)乙中A极析出的气体在标准状况下的体积为__________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3,则图中②线表示的是__________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________mL 5.0mol•L-1 NaOH溶液。
金属的腐蚀是指金属与周围接触到的气体或液体物质发生________而引起损耗的现象。金属腐蚀的本质是________________,发生________反应。一般可分为________腐蚀和________腐蚀。
写出钢铁生锈的电极反应式(水膜呈中性):
负极___________________________
正极___________________________
金属的腐蚀是指____________________________________。
由于与金属接触的介质不同,发生腐蚀的化学原理也不同,一般可分为________________________和________________________,其中________________________更为普遍。
用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,该种腐蚀属 ,反应的电极反应式为 。若用铝制饭盒盛放食盐(含水时),一段时间后,饭盒被腐蚀,这种腐蚀叫做 ,反应原理是(写电极反应式) 。
(6分)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
在空气酸度不大的环境中,其负极是 ,负极反应式为 ;
正极是 ,正极反应式为 。
(12分)烧过菜的铁锅未及时洗净,第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失 水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成:
水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成:
(1)负极______ ;
(2)正极_____  ;
;
(3)离子方程式______ ;
(4)化学方程式______ .
潜艇的金属外壳浸在海水中,在海水和空气的作用下会 被腐蚀
被腐蚀
(1)若海水呈中性,一艘钢制外壳的潜艇在海水中发生腐蚀的电极反应式为:
正极:___________________________________________________________ ______ _,负极:__________________________________________________________。
______ _,负极:__________________________________________________________。
(2)为有效地保护潜艇。下列措施中最好的是______________(填序号)
| A.采用纯铁制造潜艇外壳 | B.采用耐腐蚀的合金制造潜艇外壳 |
| C.在潜艇上涂一层油 | D.在潜艇外壳上装一定数量的锌块 |
下图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e的电极材料为 ,f极上发生的反应为: 。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极: ;负极: 。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用 。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的 极。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
① 碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是____(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的____.。
a.NH3 b.CO2 c.NaOH d.HNO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生此现象的原因(用离子方程式表示)_____。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是______。
(3)利用下图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
(9分) 右图所示水槽中试管内有一枚铁钉,放置数天后观察: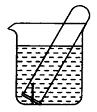
(1)铁钉在逐渐生锈,则铁钉的 腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)
腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的SO42-还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
①写出该电化腐蚀的正极反应的电极反应式:
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 |
内容 |
实验现象 |
| 1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
| 2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
| 3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
| 4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
| 5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
| 6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号);在电化学腐蚀中,负极反应是;正极反应是;
(2)由该实验可知,可以影响铁锈蚀速率的因素是;
(3)为防止铁的锈蚀,工业上普遍采用的方法是(答两种方法)