(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,该原电池的负极是 ,负极反应式为 ;正极是 ,正极反应式为 。
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示) 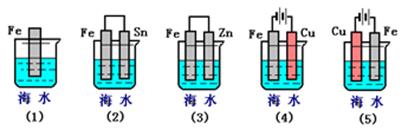
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,该原电池的负极是 ,负极反应式为 ;正极是 ,正极反应式为 。
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示) 