如图所示,将等物质量的Cl2和CH4充入一容积为 25 mL 的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是: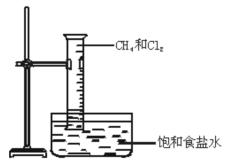
(1) ;
(2) ;
(3) 。
如图所示,将等物质量的Cl2和CH4充入一容积为 25 mL 的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是:
(1) ;
(2) ;
(3) 。